Todellinen kaasu
- 3863
- 367
- Dr. Travis Reichert
Mikä on todellinen kaasu?
Eräs todellinen kaasu Se on luonteeltaan erilaisia kemiallisia rakenteita ja joka ei osoita idealisoitua käyttäytymistä. Ne voivat olla diatomisia molekyylejä, kuten happea, typpeä jne., samoin kuin monotoomiset molekyylit, mukaan lukien helium, neon ja muut. Siellä voi olla jopa raskaampia kaasuja, esimerkiksi hiilidioksidia, metaania ja ammoniakkia.
Ihanteelliset kaasut ovat luotu malli, joka ohjaa kaasujen käyttäytymisen ymmärtämistä ennen erilaisia ympäristöolosuhteita. Benoit Paul Émile Clapeyron perusti niin kutsutun Ideal Gases -lain vuonna 1834, ilmoitettu seuraavassa kaavassa: PV = NRT.
 Jos typpi osoittaa ihanteellista eikä todellista käyttäytymistä, se ei voisi koskaan olla nesteyttämisessä ja olla olemassa kryogeenisenä nesteinä. Lähde: Stryn Wikipedian kautta.
Jos typpi osoittaa ihanteellista eikä todellista käyttäytymistä, se ei voisi koskaan olla nesteyttämisessä ja olla olemassa kryogeenisenä nesteinä. Lähde: Stryn Wikipedian kautta. Laki perustuu joukkoon oletuksia, mukaan lukien: olettaen, että kaasun molekyyleistä puuttuu mittoja, toisin sanoen ne ovat täsmällisiä ja että näiden molekyylien välillä ei ole vetovoimaa, näiden molekyylien välillä ei ole vetovoimaa.
Kuninkaalliset kaasut eivät täytä näitä oletuksia. Tietyissä olosuhteissa, kuten korkeat paineet ja matalat lämpötilat, ne pääsevät ihanteellisten kaasujen osastoon lisäämällä molekyylien välisiä voimia. Se lisää myös molekyylien tilavuuden osuutta suhteessa kaasun käyttämään kokonaistilaan.
Todellisten kaasujen ominaisuudet
Molekyylien välisten voimien olemassaolo
Kaasun molekyylien joukossa on vetovoiman voima, joka pyrkii keräämään heitä rajoittamalla heidän liikkuvuutensa. Nämä molekyylien väliset voimat tunnetaan van der Waals -joukkoina hollantilaisen tutkijan Johannes van der Waalsin kunniaksi (1837-1923).
Nämä molekyylien väliset voimat ovat Dipolo-Dipolo-vuorovaikutus ja Lontoon dispergoivat voimat. Samoin van der Waals vuonna 1873 esitteli molekyylien välisten voimien vaikutuksen kaasun tilayhtälöihin.
Kun tarkastellaan tällaista vuorovaikutusta, todellisten kaasujen käyttäytymisestä on tärkeä poikkeama ihanteellisiin kaasuihin; etenkin korkeiden paineiden ja kaasun tilavuuden vähentymisen suhteen, mikä tuottaa suuremman vuorovaikutuksen kaasumaisten molekyylien välillä.
Se voi palvella sinua: 7 kemian laboratoriokäytäntöä (yksinkertainen)Molekyylitilavuus
Ihanteellisille kaasuille osoitetuista ominaisuuksista on pidettävä niiden molekyylejä täsmällisinä; Ja siksi niiden miehittämä tilavuus kokonaiskaasutilaan on vähäinen.
Todellisen kaasun molekyylien käyttämä tilavuus voi kuitenkin olla tärkeä, kun kaasulle kohdistetaan paine, joka tuottaa sen tilavuuden vähentymisen, mikä lisää kaasumolekyylien tilavuuden osuutta suhteessa kaasun kokonaistilaan.
Tämä tilanne lisää molekyylien välisten voimien suuruutta kaasussa, kun niiden molekyylien lähestymistapa, mikä tuo joitain muutoksia kaasun ominaisuuksiin. Esimerkiksi, kaasun teoreettinen paine laskee sen sisältävän säiliön seinämiin.
Tämä johtuu siitä, että kaasumolekyylien törmäysten tiheys säiliön seiniä vasten vähenee. Samaan aikaan samojen molekyylien väliset törmäykset kasvavat, joten niiden liikkuvuus on vähentynyt.
Van der Waals -yhtälö
Oikeat kaasut voivat lähestyä ihanteellisen kaasun lain (PV = NRT) noudattamista tietyissä olosuhteissa. Mutta ei kaikissa olosuhteissa, mikä tuottaa tarvetta muuttaa vakiintunutta lakia.
Useat kirjoittajat antoivat panoksensa muutokseen, joka voisi sopeutua todellisiin kaasuihin. Näiden panosten joukossa on Van der Waals -yhtälö:
(P + an2/V2) (V-nb) = nrt
Ilmaisu (an an2/V2;. Termi 'A' on empiirinen vakio, joka on tyypillinen jokaiselle kaasulle ja joka on yksikkö L2· ATM · mol-2.
Voi palvella sinua: kaliumjodidi (KI): rakenne, ominaisuudet, hankkiminen, käyttö, riskitExpression (V-NB) korjaa kaasun molekyylien käyttämän tilavuuden huomiotta jättäminen todellisen kaasun ominaisuuksien suhteen. Termi 'b' saadaan empiirisesti ja sillä on yksikönä: l · mol-1, joiden arvo vaihtelee jokaisesta kaasusta. B. edustaa myös kaasumolekyylien käyttämää tilavuutta.
Joule-Thompson-vaikutus
Kun todellinen kaasu pakotetaan ylittämään venttiili, sen tilavuus vähenee; Mutta jättäessään sen laajenee, mikä tuottaa kaasun lämpötilan laskua. Tämä ominaisuus on löytänyt sovelluksen jäähdytyksessä.
Pakkauskerroin (z) tai kaasun puristuvuus
Kompressiokerroin (PV/NRT) on suhde, jonka mukaan ihanteellisissa kaasuissa on vakioarvo 1, riippumatta siitä, että ne altistuvat paineesta tai lämpötilasta.
Päinvastoin, todelliset kaasut, kuten: vety (H2), typpi (n2), happi (tai2) ja hiilidioksidi (CO2), on arvo suurempi kuin 1, kun niihin kohdistuva paine on suurempi kuin 400 atm.
Hiilidioksidilla ja hapella voi kuitenkin olla pakkauskertoimen arvo, joka on alle 1 alhaisemmalle paineelle alle 400 ilmakehää. Yhteenvetona: Kompressiokerroin ei ole vakio todellisissa kaasuissa.
Nesteyte
Ihanteelliset kaasut, kun se on puristus- ja adiabaattinen laajennusprosessi, vähentävät niiden lämpötilaa ja lisäävät niiden tiheyttä. Mutta ilman vaihemuutosta. Sitä vastoin todellisilla kaasuilla on vaihemuutos: ne nesteytetään, ne kulkevat nestefaasiin.
Van der Waals -yhtälösovellus
Laske metaanikaasulla (oikea kaasu) kohdistettu paine 0 -astiassa.5 l a 25 ºC.
Voi palvella sinua: kalsiumkarbidi (CAC2): rakenne, ominaisuudet, hankkiminen, käyttöa) Kun sovelletaan ihanteellinen kaasun yhtälö.
b) Kun levitetään van der Waal -yhtälöä, jonka arvo on vakio 'A' 2: lle.25 l2· ATM · mol-2 ja 0.0428 vakiona 'b'.
Alajaksossa a)
Pv = nrt
P = nrt/v
= (1 mol) (0.082 l · atm · mol-1· K-1) (298 K) / (0.50 l)
= 48.87 ATM
Ja alajaksossa b)
(P + an2/V2) (V-nb) = nrt
A = 225 l2· ATM · mol-2
B = 0.0428 L · mol-1
[P + (1 mol)2(2.25 l2· ATM · mol-2/(0.5 l)2)] [(0.500 l - 0.0428 l)] = (1 mol) (0.082 l · atm · mol-1) (298 K)
(P + 9 atm) (0.4572 l) = 24.36 atm · l
P = 44.28 ATM
Todellisen kaasun kohdistaman paineen lasku havaitaan, kun Van der Waals -yhtälöä käytetään ihanteellisen kaasun yhtälön sijasta. Tämä on seurausta molekyylien välisten voimien olemassaolosta ja gase -molekyylien tilavuudesta.
Todelliset kaasuesimerkit
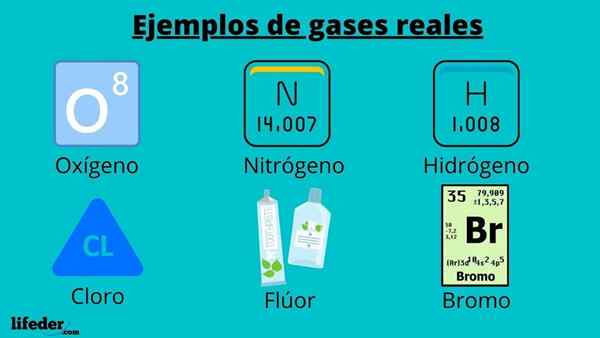
Kaikki luonnossa esiintyvät kaasut ovat todellisia, mukaan lukien kaasut, joissa on diatomisia molekyylejä, kuten happi, typpi, vety, kloori, fluori, bromi ja jodi; ja monoatomiskaasut, kuten helium, argoni, krypton, neon ja radon.
Kaasumaisessa tilassa olevien kemiallisten yhdisteiden lisäksi, kuten butaani, hiilidioksidi, rikkidioksidi, metaani, muun muassa.
Viitteet
- Walter J. Moore. (1963). Fysikaalinen kemia. Kemiallisessa kinetiikassa. Neljäs painos, Longmans.
- Iranin. Levine. (2009). Fysikaalis -periaatteet. Kuudes painos. MC Graw Hill.
- Wikipedia. (2020). Todellinen kaasu. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (25. elokuuta 2020). Oikea kaasun määritelmä ja kokeet. Toipunut: Admingco.com
- Clark Jim. (2017). Ihanteelliset kaasut ja ihanteellinen kaasulaki. Talteenotettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- Kemian librettexts. (10. toukokuuta 2019). Todelliset kaasut. Palautettu: Chem.Librettexts.org
- Esimerkkien tietosanakirja (2019). Ihanteellinen kaasu ja todellinen kaasu. Palautettu: Esimerkkejä.yhteistyö

