Tioles
- 4796
- 1182
- Mr. Clifford Kshlerin
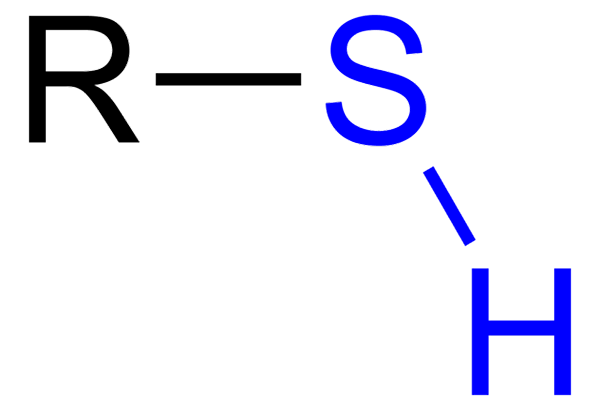
Se Tioles Ne ovat orgaanisia yhdisteitä, joissa on SH -ryhmä, nimeltään Tiol tai Sulfihydrilo -ryhmä. Sen yleinen kaava on RSH, kyky edustaa R: tä vuokralle, aryylille tai muulle kemialliselle ryhmälle. Tioolien erottuva ominaisuus on sen voimakas haiseva haju.
Joitakin tioleita käytetään antamaan palavien kaasujen haju näiden kaasujen vuodon havaitsemiseksi, mikä niiden ominaisuuksien vuoksi voi olla suuri vaarassa. Tioles ovat samanlaisia kuin alkoholit, koska niillä on OH -ryhmä, kun taas tioolit a sh.
 Tiol sinisellä sulfhydrillo -ryhmällä
Tiol sinisellä sulfhydrillo -ryhmällä Heillä puolestaan on kuitenkin useita eroja: OH -ryhmä on polaarisempi kuin SH -ryhmä, ja rikki on pienempi atomi kuin happi ja vähemmän elektronegatiivista.
Tämä määrittää, että tioles -molekyylit eivät muodosta vety sidoksia tai vettä tai niiden joukossa. Siksi tioolien liukoisuus veteen on alhainen ja sen kiehumispiste on alhaisempi kuin alkoholien kanssa, joilla on samanlaisia hiilihiiliketjuja.
Tioles ovat erityisen hyödyllisiä ja usein biokemiallisissa järjestelmissä, koska monet vastaavat biomolekyylejä, kuten koentsyymi. Sen S-H-sidos on happamempi kuin O-H, helpompi rikkoa ja myös helpompi korvata tai korvata muut molekyylifragmentit lukuisissa rikki orgaanisessa synteesissä.
[TOC]
Tioles -ominaisuudet
 Johvelien haiseva tuoksu koostuu pääasiassa tioleista
Johvelien haiseva tuoksu koostuu pääasiassa tioleista Yleisyys
OH -alkoholiryhmällä ja tiolien SH -ryhmällä on joukko fysikaalisia ja kemiallisia ominaisuuksia kuuluvan hapen ja rikkiä varten samaan jaksollisen taulukon kemialliseen ryhmään (ryhmän kautta).
LOA TIOéters, Unioketaalit ja tioésterit, jotka ovat analogisia alkoholien muodostamien kemiallisten yhdisteiden kanssa, kuten eetterit, asetaalit ja esterit. S-H- ja O-H-linkit aiheuttavat kuitenkin joitain eroja, jotka heijastuvat tiolien ja alkoholien ominaisuuksissa.
Haju
Pienen molekyylipainon tiolien ominaisuus on sen epämiellyttävä haju, samanlainen kuin valkosipuli ja sipuli. Tämä haju on niin suurta, että ihmisen haju on tiolin yhden osan kynnys kymmenestä miljardista ilmasta.
Etanotiolia lisätään maakaasuun turvatoimenpiteenä, jotta voidaan havaita syttyvät, mutta itse wc poistuu itse. Tioolien haju vähenee lisäämällä niiden ketjun hiilihiilien lukumäärää, koska Tiol -rikin volatiliteetti ja osuus vähenevät.
Voi palvella sinua: ammoniumfosfaatti: rakenne, ominaisuudet, hankkiminen, käyttöKiehumispiste ja liukoisuus
Tioolien S-H-linkissä on dipolin hetki vähemmän kuin alkoholien O-H-linkki. Lisäksi rikkiatomi on pienempi ja pienempi elektronegatiivisuus kuin happiatomi.
Tämä määrittelee, että tioles -molekyylit eivät voi muodostaa vety sidoksia veteen tai niiden joukossa, mikä aiheuttaa eron tiolien ja alkoholien fysikaalisten ominaisuuksien välillä. Esimerkiksi: Metanotiol (CHO3Sh) kiehumispiste on 6 ºC, kun taas metanoli (CHO3OH) kiehuu 65 ° C: ssa.
Siksi huoneenlämpötilassa (25 ºC) metanoli on neste ja metanotioli on kaasu.
Yhteenvetona: Thioles on alhaisempi kiehumispiste kuin vastaavilla esitetyillä alkoholilla. Samoista syistä tioolien liukoisuus veteen ja muihin polaarisiin liuottimiin on erittäin alhainen. Samaan aikaan pienimolekyylipainoiset alkoholit ovat hyvin liukoisia veteen.
Reaktiivisuus
S-H-linkki on heikompi kuin O-H-sidos, joten linkki S-H dissosioituu helpommin, mikä tekee tioleista vahvoja hapoja kuin alkoholit. Suurimmalla osalla alkoholia on PKA 16-18, kun taas tioleilla on PKA noin 11.
Tämä sallii tiolit-): Erittäin vahva nukleofiilinen aine.
SH-ryhmä voi hapettua muodostamaan disulfidiyhteyksiä (-s-s-), joita esiintyy glutationisessa hapettumisessa: soluissa esiintyvä tioli ja jolla on antioksidanttitoiminto.
Bromo tai muut halogeenit, samoin kuin happi, voivat toimia tiolissa muodostamaan disulfuriltoja:
2 RSH +BR → R-S-S-R '+2 HBR
RSSR: n yhdisteet tunnetaan orgaanisina sulfideina ja alkiileina, r2S.
Toisaalta voimakkaat hapettavat aineet, kuten natriumhypokloriitti ja vetyperoksidi, voivat vaikuttaa tioleihin aiheuttamaan sulfonihappoja:
RSH +H2JOMPIKUMPI2 → RSO3H +3 H2JOMPIKUMPI
Nimikkeistö
Tiolien IUPAC.
Siten esimerkiksi stanoperäistä ohdatana kutsutaan 1-bunotanotioliksi, ch3CH2CH2CH2Sh, mikä osoittaa lukumäärän kanssa SH -ryhmän sijainnin ketjun hiilihiilissä.
Voi palvella sinua: kationi: koulutus, erot anionin ja esimerkkien kanssaSamoin on toinen nimikkeistö, jälleen samanlainen kuin alkoholit: sana 'alkoholi' korvataan 'merkaptaanilla' alkoholien nimissä. Esimerkiksi Cho3Sh, analoginen metyylialkoholille, ch3Voi, kutsutaan metyyli- tai merkaptaani merkaptaaniksi.
Toinen esimerkki olisi CHO3CH2Ch (sh) ch3, Kutsu. Toisin sanoen painotetaan R: n identiteettiä RSH -kaavassa. Siksi myös muut alkoholinimikkeistön normit täyttyvät myös tioleista.
Ja lopuksi, kun SH -ryhmä on läsnä suuremmassa rakenteessa tai missä tärkeimmät ryhmät ovat vallitsevia, käytetään sulfihydrilo- tai merkapto -etuliitettä.
Esimerkiksi yhdistelmä CH3CH2CH (sh) -koki3 Sitä kutsutaan 3-merkapto-2-penonaksi. Huomaa, että SH: lla on vähemmän prioriteettia kuin hapetetut ryhmät (paitsi eetteri), joten pienet numerot vastaavat sitä.
Synteesi
Tioolien synteesimenetelmä koostuu tiotan reaktiosta alkyylihalogenidilla, joka tuottaa IsoTiouronin välisuolaa. Tätä hydrolysoituu natriumhydroksidilla tiolin ja urean saamiseksi.
CH3SH valmistetaan teollisesti rikkivetyön reaktiolla metanolin kanssa happakatalyyttien läsnä ollessa:
CH3Voi +h2S → ch3Sh +h2JOMPIKUMPI
Toisessa tuotantomenetelmässä alkyylihalogenidi reagoitiin natriumhydrosulfuron kanssa:
RX +Nash → RSH +Nax
Sovellukset
Entsyymin kiinnitys, joka on kytketty nanohiukkasiin
Tioleja käytetään sillaina liittyäkseen nanohiukkasten entsyymikompleksiin kultaelektrodeihin. Esimerkiksi tioleita käytetään nanohiukkasten ja Uricasa-kompleksin kiinnittämiseen, entsyymiin, joka puuttuu virtsahapon muuntamiseen allantiiniksi.
Tiol -ei -reaktio
Se on orgaaninen reaktio Tiolin ja alkeenin välillä, kutsuen “napsautuksen” reaktiota; Että muun muassa se on korkean suorituskyvyn reaktio, laaja laajuus, joka luo eliminoitavissa olevilla tuotteilla ei -kromatografisilla menetelmillä, ja se on myös helppo suorittaa.
Tiol -NO -reaktiolla on sovelluksia TiOazúcarin synteesissä: Salicinolissa, a -glykosidaasin estäjällä, sokerissa. Salicinol on eristetty Sri Lankassa ja Intiassa käytetyistä kasveista diabeteksen hoidossa.
Lisäksi tiol -NO -reaktiota käytetään hiilihydraattien, polymerointien, pintakemian, synteesikemian ja peptidien kemian kemiassa.
Voi palvella sinua: Jäätymiskohta: Kuinka laskea se ja esimerkkejäHajuaineet
 Keittiön kaasu on wc, mutta pienimolekyylipainoisten tioolien koostumuksensa ansiosta sillä on erottuva haju
Keittiön kaasu on wc, mutta pienimolekyylipainoisten tioolien koostumuksensa ansiosta sillä on erottuva haju Alifaattiset tioolit pienimolekyylipainosta sisällytetään maakaasuihin siten, että niiden vahva haju toimii varoituksena paeta tai kaasun vuotaminen.
Lääke
Penicilamine (C5HyksitoistaEI2S) Se on lääke, jota käytetään Wilsonin taudin ja nivelreuman hoidossa.
Ja kapteeni (C9HviisitoistaEI3S), toisaalta sitä käytetään valtimoverenpainetaudin hoidossa ja kongestiivisessa sydänsairaudessa.
Molemmat ovat esimerkkejä tiooleista, joissa on lääkkeitä.
Biologinen
Tioles -ryhmiä on läsnä muiden yhdisteiden joukossa, joilla on biologinen toiminta, kysteiinissä, koentsyymissä A ja glutationissa.
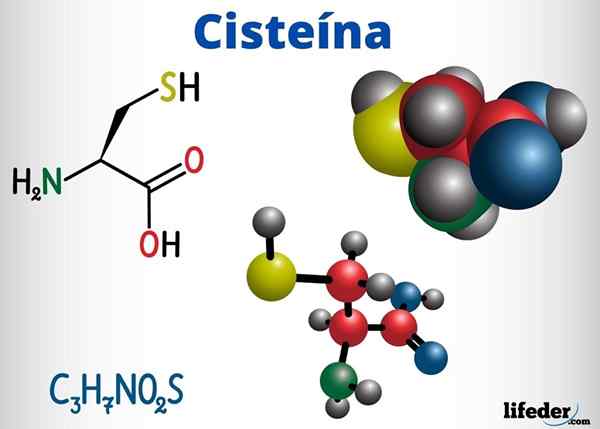
Kysteiini on aminohappo, joka kykenee muodostamaan disulfuriltoja sen proteiiniketjussa, siksi vastuussa proteiinin tertiäärisestä rakenteesta. Se voi myös muodostaa disulf -sillat eri proteiiniketjujen välillä, aiheuttaen proteiinien kvaternäärisen rakenteen.
Kysteiini sijaitsee lukuisten entsyymien aktiivisissa keskuksissa ja sillä on myös antioksidanttivaikutus.
Glutationi on erittäin tärkeä antioksidantti solunsisäinen vaikutus, joka antaa suojaa soluille ja makromolekyyleille, jotka säveltävät.
Coenzyme A puolestaan on tioli, joka puuttuu rasvahappojen synteesiin ja hapettumiseen. Lisäksi koentsyymi asetyylkosyymi A: n muodossa puuttuu sitruunahapposyklin tai Krebs -syklin alussa.
Esimerkit
Lopuksi, jotkut tioles -nimet luetellaan niiden molekyylimuodoilla:
-Tioetikkahappo (C2H4SINÄ)
-Koentsyymi A (CkaksikymmentäyksiH36N7JOMPIKUMPI16P3S)
-Vähentynyt glutaatio (C10H17N3JOMPIKUMPI6S)
-Kysteiini (c3H7EI2S)
-Merkaptanoli (C2H6SINÄ)
-Metanotioli (CH3Sh)
-1-propanotioli (C3H7Sh)
-Butanotioli (c4H 9Sh)
-Tiofenoli tai tiomeerosaali (c6H6S)
-Pomelo Mercaptano (C10H18S)
-Heksadekanotioli (c6H3. 4S)
-Penisillamiini (c6HyksitoistaEI2S)
-Kapteeni (c9HviisitoistaEI3S)
-Etanotioli (C2H6S)
-2-propenetiol (C3H6S)
-Α-lipoic tai lipoamidi (C8H14JOMPIKUMPI2S2-A. Se on syklinen disulfidi.
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10th Painos.-A. Wiley Plus.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Morrison ja Boyd. (1987). Orgaaninen kemia. (Viides painos). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Tioli. Haettu: vuonna.Wikipedia.org
- DR. Dietmar Kennepohl et ai. (13. syyskuuta 2020). Tiolit ja sulfidit. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Enyclopaedia Britannica -toimittajat. (2020). Tioli. Toipunut: Britannica.com
- Nolan MD ja Scanlan EM (2020) Tiol-eenin kemian sovellukset peptiditieteelle. Etu. Kemia. 8: 583272. Doi: 10.3389/FCHEM.2020.583272
- DR. Carl C. Heiluttaja. (1999). Luku 9: Alkoholit ja tiolit. Haettu: Web.Pdx.Edu

