Kaasuominaisuudet, käyttäytyminen, muoto, esimerkit

- 4210
- 615
- Ronald Reilly
Se Kaasut Ne ovat kaikkia aineita tai yhdisteitä, joiden aggregaatiotilat ovat heikkoja ja dispergoituneita, samalla kun ne hallitsevat paine- ja lämpötila -olosuhteet, jotka hallitsevat suuresti. Ehkä muodostaa toisen aineen muodon runsaammin koko maailmankaikkeudessa plasman jälkeen.
Maapallolla kaasut muodostavat ilmakehän kerrokset eksosfääristä troposfääriin ja hengittämämme ilmaan. Vaikka kaasu on näkymätön, kun sitä leviää suuret tilat, kuten taivas, se havaitaan pilvien liikkumisella, tehtaan terien käännöksillä tai suutemme uloshengitetyillä höyryillä kylmässä ilmastossa.
 Kaasuja voidaan havaita teollisuus- tai kodin savupiippuissa, samoin kuin tulivuorien nousevissa savutorneissa. Lähde: Pxhere.
Kaasuja voidaan havaita teollisuus- tai kodin savupiippuissa, samoin kuin tulivuorien nousevissa savutorneissa. Lähde: Pxhere. Samoin ympäristön negatiivisiin näkökohtiin, sitä havaitaan ajoneuvojen pakoputken mustassa savussa, tehtaissa sijaitsevien tornien savupylväissä tai savussa, kun metsä palaa, kun metsä palaa.
Se on myös kaasumaisia ilmiöitä, kun näkyy höyryjä, jotka jättävät viemärit, suon ja hautausmaiden kohtalokkaisiin tulipaloihin, kasvituotteiden vapauttamassa kupli -happea ja jopa eruutissa ja litteässä.
Missä tahansa kaasuja havaitaan, se tarkoittaa, että kemiallinen reaktio oli, elleivät ne ole kiinnitetty tai rinnastettu suoraan ilmasta, planeetan päälähde (pinnallisesti). Lämpötilojen noustessa jokainen aine (kemialliset elementit) muuttuu kaasuiksi, mukaan lukien metallit, kuten rauta, kulta ja hopea.
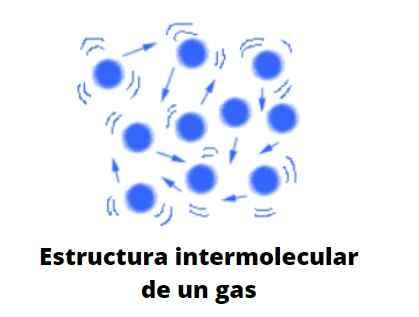
Kaasujen kemiallisesta luonteesta riippumatta jokaisella on yhteinen suuri etäisyys, joka erottaa niiden hiukkaset (atomit, molekyylit, ionit jne.), jotka liikkuvat kaoottisesti ja mielivaltaisesti tietyllä tilavuudella tai tilalla.
[TOC]
Kaasuominaisuudet
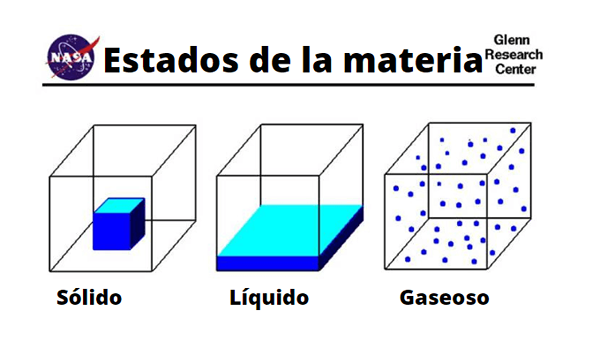 Kiinteän, nesteen ja kaasumolekyylin erot
Kiinteän, nesteen ja kaasumolekyylin erot Fyysinen
Kaasujen fysikaaliset ominaisuudet vaihtelevat riippuen siitä, mikä aine tai yhdiste on. Kansalaiset ovat suosittuja huonoja hajuja tai mätää heidän rikkipitoisuutensa tai haihtuvien amiinien läsnäolon vuoksi. Samoin ne visualisoivat vihreät, ruskeat tai kellertävät värit, jotka pelottavat ja antavat huonon omenan.
Useimmat kaasut tai ainakin runsas eniten ovat todella värittömiä ja hajuttomia. Vaikka ne olisikaan ansainnut, ne voidaan tuntea iholla ja vastustaa liikkeenkestävyyttä, jopa luomalla viskoosikerroksia niiden ylittäviin kehoihin (kuten lentokoneiden kanssa).
Kaikilla kaasuilla voi kokea paine- tai lämpötilan muutoksia, jotka päätyvät vastaaviin nesteisiin; toisin sanoen he kärsivät tiivistymisestä (jos ne jäähdytetään) tai nesteyttämisessä (jos niitä "painostetaan").
 Tiivistyminen; kaasumainen tila nestemäiseen tilaan
Tiivistyminen; kaasumainen tila nestemäiseen tilaan Toisaalta kaasut kykenevät liuottamaan nesteitä ja joitain huokoisia kiinteitä aineita (kuten aktivoitu hiili). Kuplat ovat seurausta kaasuklustereista, jotka eivät ole vielä liuenneet keskelle ja pakenevat nesteen pintaan.
Sähkö- ja lämmönjohtavuus
Normaaliolosuhteissa (ilman niiden hiukkasten ionisointia) kaasut ovat huonoja lämmön ja sähköntekijöitä. Kuitenkin, kun ne ovat jännittyneitä monien elektronien kanssa, ne sallivat virran kulkemisen niiden läpi, kuten myrskyjen aikana säteissä nähdään.
Toisaalta alhaisissa paineissa ja sähkökentällä altistuneita kaasuja, etenkin jalo tai täydellisiä, valaisevat ja niiden valoja käytetään yöelämän ja julisteiden (neonvalon) suunnitteluun sekä kuuluisassa sähköiskissä Lamput kadun lyhtyillä.
Voi palvella sinua: Granataria tasapaino: Ominaisuudet, osat ja sen käyttöäLämmönjohtavuuden suhteen monet kaasut käyttäytyvät lämpöeristiminä, joten niiden sisällyttäminen kuitujen, kudosten tai lasipaneelien täyttämiseen auttaa estämään lämpöä niiden panemasta ja pitämään lämpötilan vakiona.
On kuitenkin kaasuja, jotka ovat hyviä lämmönjohtimia ja voivat aiheuttaa pahempia palovammoja, jotka aiheuttavat nesteitä tai kiinteitä aineita; Esimerkiksi, kuten leivottujen kakkujen (tai empanadas) tai kattiloista päästävän höyrysuihkujen kuuman höyryn kanssa.
Reaktiivisuus
Yleensä kaasuja koskevat reaktiot tai jos niitä esiintyy, kuvataan vaarallisiksi ja hankaliksi.
Hänen reaktiivisuutensa riippuu jälleen niiden kemiallisesta luonteesta; Laajentuessaan ja mobilisoidessa suuresti on kuitenkin otettava enemmän hoitoa ja hallintaa, koska ne voivat laukaista dramaattisia paineita, jotka aiheuttavat reaktorin rakenteen vaaraan; Puhumattakaan siitä, kuinka syttyvät tai eivät ole onnellisia kaasuja.
Kaasulaite
Makroskooppisesti voidaan antaa käsitys kaasujen käyttäytymisestä todistamalla, kuinka savukkeiden savu, renkaat tai kirjalliset "kielet" kehittyvät ilmassa. Lisäksi, kun savukranaatti räjähtää, on mielenkiintoista yksityiskohtaisesti näiden eri värien pilvien liikettä.

Tällaiset havainnot ovat kuitenkin ilmavaikutuksia ja myös sitä, että savussa on suspendoitu erittäin hienoja kiinteitä hiukkasia. Siksi nämä esimerkit eivät riitä päätelmään kaasun todellisesta käytöksestä. Sen sijaan on tehty kokeita ja kehitetty kaasujen kineettinen teoria.
Molekyyli ja ihannetapauksessa kaasumaiset hiukkaset törmäävät elastical toistensa kanssa, ja niiden lineaariset, kierto- ja värähtely siirtymät. Heillä on keskimäärin liittyvä energia, jonka avulla se voi kulkea vapaasti minkä tahansa tilan läpi ilman melkein vuorovaikutusta tai törmää toisen hiukkasen kanssa, kun tilavuus kasvaa niiden ympärillä.
Sen käyttäytyminen olisi sekoitus Brownian epätavallista liikettä ja biljardipallojen törmäyksiä, jotka pomppivat jatkuvasti toisiinsa ja pöydän seiniin; Jos seiniä ei ole, ne leviävät kohti äärettömyyttä, elleivät ne pidä niitä: painovoima.
Kaasun muoto
Kaasut, toisin kuin nesteet ja kiinteät aineet, eivät ole kondensoituneen tyypin alaisia; Eli niiden hiukkasten aggregaatio tai koheesio ei koskaan onnistu määrittelemään muotoa. He jakavat nesteiden kanssa tosiasian, että ne ovat täysin niitä sisältävien säiliön määrän; Niistä ei kuitenkaan ole pinta- ja pintajännitystä.
Jos kaasukonsentraatio on korkea, jo kuvattu "kielet" tai makroskooppiset muodot voidaan visualisoida paljaalla silmällä. Nämä ennemmin tai myöhemmin lopulta häipyvät tuulen vaikutuksen tai pelkän kaasun laajentumisen vuoksi. Siksi kaasut kattavat kaikki rajoitetun tilan kulmat, jotka aiheuttavat erittäin homogeenisia järjestelmiä.
Nyt teoria pitää kätevästi kaasuja palloina, jotka tuskin törmäävät itsensä kanssa; Mutta kun he tekevät niin, he pomppiivat elastisesti.
Nämä pallot ovat hyvin erotettuja toisistaan, joten kaasut ovat käytännössä "täynnä" tyhjiötä; Sieltä olet velkaa monipuolisuudestasi ylittää pienimmätkin raon tai halkeaman ja helpon kyvyn puristaa niitä merkittävästi.
Voi palvella sinua: ei -metalliset oksiditSiksi kuitenkin suljettiin leipomon asennus, jos kävellessä vierekkäin on varmaa, että juuri leivonnaisen leivän tuoksu nautitaan.
Kaasupaine
Voidaan uskoa, että niin hajallaan ja erottamalla kaasupallot tai hiukkaset eivät pysty tuottamaan mitään paineita rungoille tai esineille. Ilmapiiri osoittaa kuitenkin, että tällainen uskomus on väärä: sillä on massa, painaa ja estää nesteet haihtumasta tai kiehumasta tyhjästä. Kiehumispisteet mitataan ilmakehän paineessa.
Kasauspaineet muuttuvat kvantitatiivisemmiksi, jos manometrit ovat saatavilla tai jos ne on lukittu epämuodostumattomista seinasäiliöistä. Siten mitä enemmän kaasuhiukkasia on säiliön sisällä, sitä suurempi niiden ja saman seinämien välisten törmäysten lukumäärä on.
Nämä hiukkaset, kun törmäävät seiniin, puristavat niitä, koska ne käyttävät pintaansa voiman, joka on verrannollinen heidän kineettiseen energiaansa. Vaikuttaa siltä, että seinälle olevat ihanteelliset biljardipallot olisivat hukkua; Jos on monia, jotka vaikuttavat heihin suurella nopeudella, se voi rikkoa.
Yksiköt
On monia yksiköitä, jotka seuraavat kaasun paineen mittauksia. Jotkut tunnetuimmista ovat elohopean millimetrit (MMHG), samoin kuin torr. Ovat kansainvälisen yksikköjärjestelmän (SI), jotka määrittelevät Pascal (PA) N/M: n suhteen2; Ja hänestä, kilo (KPA), Mega (MPA) ja Giga (GPA) Pascal.
Kaasun tilavuus
Kaasu käyttää ja laajenee koko säiliön määrän ajan. Mitä suurempi säiliö, myös kaasutila on; Mutta sekä niiden paine että tiheys vähenevät saman määrän hiukkasia.
Itse kaasulla puolestaan on siihen liittyvä tilavuus, joka ei riipu niin paljon sen molekyylisesta luonteesta tai rakenteesta (ihannetapauksessa), vaan sitä hallitsevista paine- ja lämpötila -olosuhteista; Tämä on sen molaarinen tilavuus.
Todellisuudessa molaarinen tilavuus vaihtelee kaasusta toiseen, vaikka variaatiot ovat pieniä, jos ne eivät ole heterogeenisiä ja suuria molekyylejä. Esimerkiksi ammoniakin molaarinen tilavuus (NH3, 22 079 l/mol) 0 ºC: n ja 1 atm: n lämpötilassa eroaa heliumista (HE, 22 435 l/mol).
Kaikilla kaasuilla on molaaritilavuus, joka muuttuu p: stä riippuen, ja riippumatta siitä, kuinka suuret niiden hiukkaset ovat, niiden lukumäärä on aina sama. Tästä eteenpäin hän sai sen, mitä Avogadro -numerolla tiedetään (n-Lla-A.
Kaasujen päälaki
Gase -käyttäytyminen on opiskellut aikaisempien vuosisatojen ajan kokeiden, syvien havaintojen ja tulosten tulkinnan avulla.
Tällaiset kokeet sallivat sarjan lakeja, jotka samaan yhtäliseen (ihanteellisten kaasujen) kerättyihin auttavat ennustamaan kaasun vasteet erilaisiin paine- ja lämpötilaolosuhteisiin. Tällä tavoin sen tilavuuden, lämpötilan ja paineiden sekä heidän moolien lukumäärän välillä tietyssä järjestelmässä on suhde.
Näiden lakien joukossa ovat seuraavat neljä: Boyle, Charles, Gay-Lussac ja Avogadro.
Boyle -laki
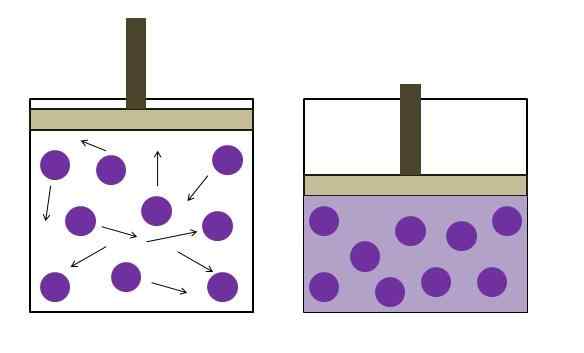 Lisääntynyt paineen vähentämispaine. Lähde: Gabriel Bolívar
Lisääntynyt paineen vähentämispaine. Lähde: Gabriel Bolívar Boylen laki osoittaa, että vakiossa lämpötilassa ihanteellisen kaasun tilavuus on käänteisesti verrannollinen sen paineeseen; Tämä on, mitä suurempi säiliö, sitä alhaisempi paine, jota sen seinät kokevat samalla määrällä kaasua.
Se voi palvella sinua: Charles Law: kaavat ja yksiköt, kokeilu, harjoituksetCharles Law
 Kiinalaiset lyhdyt tai toiveet. Lähde: Pxhere.
Kiinalaiset lyhdyt tai toiveet. Lähde: Pxhere. Charlesin laissa todetaan, että jatkuvassa paineessa ihanteellisen kaasun tilavuus on suoraan verrannollinen sen lämpötilaan. Ilmapallot osoittavat Charlesin '.
Gay-Lussacin laki
Gay-Lussacin laissa todetaan, että jatkuvalla tilavuudella ihanteellisen kaasun paine on suoraan verrannollinen sen lämpötilaan. Kutsun suljetussa patassa, jos kaasu lämpenee asteittain, joka kerta kun paine sisällä on suurempi, koska patan seinät eivät ole muodonmuutos tai laajentuneet; Toisin sanoen sen tilavuus ei muutu, se on vakio.
Avogadro -laki
Lopuksi Avogadron laissa todetaan, että ihanteellisen kaasun käyttämä tilavuus on suoraan verrannollinen sen hiukkasten lukumäärään. Siten se on, jos sinulla on hiukkasia (6,02,1023), sitten kaasun molaarinen tilavuus on.
Kaasutyypit
Palavat kaasut
Nämä ovat kaasuja, joiden komponentit toimivat polttoaineina, koska niitä käytetään lämpöenergian tuotantoon. Jotkut niistä ovat maakaasua, nesteytetty öljy ja vetykaasu.
Teollisuuskaasut
Nämä ovat valmistettuja kaasuja, joita markkinoidaan yleisölle erilaisissa käytöissä ja sovelluksissa, kuten terveysaloilla, elintarvikkeissa, ympäristönsuojelussa, metallurgiassa, kemianteollisuudessa, turvallisuudessa. Jotkut näistä kaasuista ovat happi, typpi, helium, kloori, vety, hiilimonoksidi, propaani, metaani, typpioksidi.
Hitauskaasut
Ne ovat kaasuja, jotka tietyissä lämpötila- ja paine -olosuhteissa eivät tuota kemiallista reaktiota tai erittäin alhaisia. He ovat neon, argon, helium, Kripton ja Xenon. Niitä käytetään kemiallisissa prosesseissa, joissa ei -reaktiiviset elementit ovat välttämättömiä.
Esimerkkejä kaasumaisista elementeistä ja yhdisteistä
Mitkä ovat jaksollisen taulukon kaasumaiset elementit maanpäällisissä olosuhteissa?
Meillä on ensin vetyä (H), joka muodostaa H -molekyylejä2. Sitä seuraa helium (He), kevyempi jalokaasu; ja sitten typpi (n), happi (O) ja fluoridi (F). Nämä kolme viimeistä muodostavat myös diatomisia molekyylejä: n2, JOMPIKUMPI2 ja f2.
Kun fluori tulee neon (NE), heliumia seuraavan jalokaasun. Fluorin alla meillä on klooria (CL) CL -molekyylien muodossa2.
Sitten meillä on loput jalokaasut: Argon (AR), Kripton (KR), Xenón (XE), Radon (RN) ja Oganeson (OG).
Siksi ne ovat yhteensä kaksitoista kaasumaista elementtiä; Yksitoista, jos suljetaan pois erittäin radioaktiivinen ja epävakaa Oganeson.
Kaasumaiset yhdisteet
Kaasumaisten elementtien lisäksi luetellaan joitain yleisiä kaasumaisia yhdisteitä:
-H2S, rikkivety, joka on vastuussa mätäisten munien hajusta
-Nh3, ammoniakki, se tunkeutuva tuoksu, joka havaitaan käytetyissä saippuissa
-Yhteistyö2, Hiilidioksidi, kasvihuonekaasu
-EI2, typpidioksidi
-Ei, typpimonoksidi, kaasu, jonka uskottiin erittäin myrkylliseksi, mutta jolla on tärkeä rooli verenkiertoelimessä
-Sw3, Rikkitrioksidi
-C4H10, butaani
-HCL, vetykloridi
-JOMPIKUMPI3, otsoni
-SF6, Rikin heksafluori
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Kaasujen ominaisuudet. Haettu: Chemed.Kemia.Purduke.Edu
- Wikipedia. (2019). Kaasu. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (5. joulukuuta 2018). Kaasut - Kaasujen yleiset ominaisuudet. Toipunut: Admingco.com
- Harvardin miesten terveyskello. (2019). Kaasutila. Toipunut: terveys.Harvard.Edu
- Elektroniikan jäähdytystoimittajat. (1. syyskuuta 1998). Kaasujen lämmönjohtavuus. Toipunut: elektroniikkajäähdytys.com
- « Demonologiahistoria, mitä tutkimusta ja kuuluisia demonologeja
- Graafiset romaaniominaisuudet, elementit, esimerkit »

