Globiinin ominaisuudet, rakenne, toiminta ja muutokset
- 4628
- 419
- Louis Moen
Se globiini Se on proteiinin luonteen rakenne, joka on järjestetty pallomaiseen tai pallomaiseen muotoon, koska sen nimi tulee. Tämä rakenne on tertiäärinen tyyppi, ja sille on ominaista monimutkainen, koska aminohappiketjun laskoset muodostuvat pallohoidon muodostamiseksi. Globin -ketjuja on useita tyyppejä, ja ne luokiteltiin kreikkalaisiin kirjaimiin: Alfa, beeta, delta, gamma, Epsilon ja Zeta.
Aminohapot, jotka muodostavat proteiinin primaarirakenteen, vaihtelevat niiden lajien mukaan, joihin ne kuuluvat (ihmiset tai eläimet). Samassa lajissa on myös variaatioita organismin nykyisen tilanteen mukaan (alkion elämä, sikiön elämä tai syntymän jälkeinen).
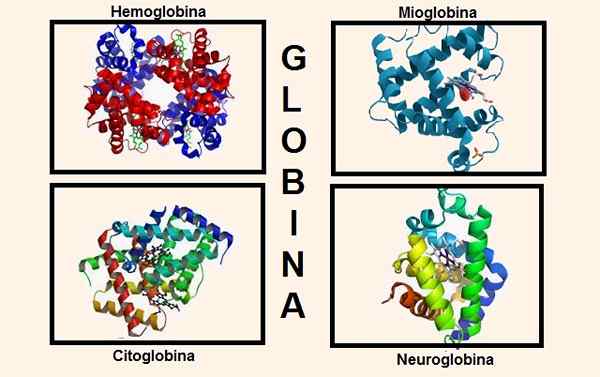
 Erilaiset rakenteet, jotka sisältävät globiinia sen koostumuksessa. Lähteet: Wikipedia.com/biancadescals [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]/Alkuperäinen lähettäjä oli proteinboxbot englanniksi Wikipedia. [Julkinen verkkotunnus]/Wikipedia.com
Erilaiset rakenteet, jotka sisältävät globiinia sen koostumuksessa. Lähteet: Wikipedia.com/biancadescals [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]/Alkuperäinen lähettäjä oli proteinboxbot englanniksi Wikipedia. [Julkinen verkkotunnus]/Wikipedia.com Geneettinen tieto erilaisten globiiniketjujen synteesiä varten sisältyy erilaisiin kromosomeihin. Esimerkiksi kromosomista 16 löytyy alfaketjun globineja, kun taas beeta-, delta-, gamma- ja epsilon -geneettiset tiedot ovat kromosomissa 11.
[TOC]
Ominaisuudet
Globiini on osa kehon tärkeitä rakenteita, esimerkiksi merkittävimmät ovat: hemoglobiini ja myoglobiini.
Hemoglobiini sisältää neljä globiiniketjua (Alfa 1 ja Alfa 2) ja (beeta 1 ja beeta 2). Jokaisella globiinilla on replikaatio, jossa se suojaa HEMO -ryhmää.
Toisaalta siellä on myoglobiini. Jolla on vähemmän monimutkainen rakenne kuin hemoglobiini. Tämä esittelee yhden -strip globaalin polypeptidin, joka on järjestetty sekundaarisesti.
Viime aikoihin asti uskottiin, että nämä olivat ainoat aineet, jotka sisälsivät globiinia korkeammissa olennoissa, mutta nykyään kaksi muuta tiedetään, joilla on globiini perustuslaissa: sytoglobiini ja neuroglobiini.
Sytoglobiini on läsnä useimmissa kudoksissa ja se sijaitsee erityisesti sidekudoksessa, samoin kuin se on löydetty verkkokalvosta.
Neuroglobiini puolestaan on mieluummin hermokudos, joten sen nimi. Neuroglobiinia on löydetty aivojen hermosoluista, jotka sijaitsevat aivokuoren tasolla, samoin kuin muissa paikoissa, kuten talamus, hypotalamus, hippokampus ja pikkuaiva.
Voi palvella sinua: Linnean -taksonomia elävistä olentoistaNe eivät kuitenkaan ole ainoita sijainteja, koska hermoston ulkopuolella sitä löytyy haiman Langerhansin saarekkeista ja verkkokalvosta.
Rakenne
Kreikan aakkosten kirjaimilla on 6 erityyppistä globiiniketjua: alfa (a), beeta (β), gamma (γ), delta (Δ), epsilon (ε) ja zeta (ζ). Nämä ketjut kuuluvat Globinas -perheeseen, mutta eroavat toisistaan heidän hallussaan olevien aminohappojen lukumäärässä.
Näillä polypeptideillä on ensisijainen, toissijainen ja tertiäärinen rakenne. Yksinkertainen aminohappoketju edustaa ensisijaista rakennetta. Kun ketju rullataan muodostamalla spiraalit tai potkurit muodostavat toissijaisen rakenteen.
Jos tämä rakennetta sitten taittaa useita kertoja itsessään, se muodostaa pallomaisen rakenteen, joka vastaa tertiääristä rakennetta.
Samoin ne voivat hankkia kvaternäärisen muodon vain, kun 4 molekyyliä tai globiiniketjua yhdistetään tertiääriseen muodossa.
Tämä esitetään hemoglobiinin monimutkaisessa rakenteessa. Myoglobiinissa se on kuitenkin erilainen. Tässä tapauksessa globiini esitetään monomeerinä, ts. Siinä on yksi peptidiketju, joka on järjestetty taittuiksi, luomalla 8 potkuria (toissijainen rakenne).
Sekä hemoglobiini- että myoglobiini -talo Hemo -ryhmä niiden monimutkaisen rakenteen sisällä.
Hemoglobiini
Tässä molekyylissä on liitetty 2 alfa -globiiniketjua ja 2 beetaketjua. Näin he ovat täydellisesti kytkettyjä Hemo -ryhmän sijoittamiseen sen keskellä sekä rautaa.
Näistä rakenteista on heikkoja ammattiliittoja ja vahvoja ammattiliittoja. Heikoilla ammattiliittoissa osallistuu 19 aminohappoa ja liitto tapahtuu seuraavasti: Alfa 1 -ketju liittyy Beta 2 -ketjuun ja Alfa 2 -ketju liittyy beetaketjuun 1.
Kun taas 35 aminohappoa ja liittyvät ketjut ovat: Alfa 1 -ketju liittyy Beta 1 -ketjuun ja Alfa 2 -ketju liittyy Beta 2 -ketjuun 2.
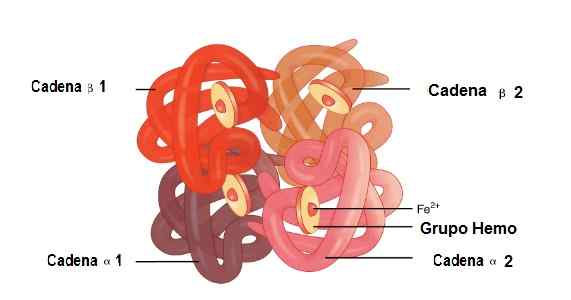 Alfa 1: n ja Alfa 2: n, beeta 1 ja beeta 2 ketjujen sijainti hemoglobiinirakenteessa. Lähde: OpenX College [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] muokattu kuva (käännetty espanjaksi)
Alfa 1: n ja Alfa 2: n, beeta 1 ja beeta 2 ketjujen sijainti hemoglobiinirakenteessa. Lähde: OpenX College [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] muokattu kuva (käännetty espanjaksi) Myoglobiini
Myoglobiinissa on myös globaali proteiiniryhmä, mutta tässä tapauksessa on yksi peptidiketju, joka koostuu 153 aminohapposta. Sen alueellinen sijoitus on toissijaista ja esittelee 8 alfa -potkuria.
Se voi palvella sinua: Oligotes: mitä ne ovat, mitä ne ovat ja mitä ovatTämä proteiinirakenne sijoittaa strategisesti hydrofobisia aminohappoja rakenteeseen, kun taas hydrofiiliset tai polaariset aminohapot löytyvät ulospäin.
Tämä malli on täydellinen HEMO -ryhmän sijoittamiseen sisällä (hydrofobinen osa). Tämä sitoutuu proteiiniin ei -kovalenttisilla sidoksilla.
Sytoglobiini
Se löydettiin vuonna 2001 ja sanotaan, että se on eräänlainen hemoglobiini, mutta se eroaa siinä, että se on heksakoordinoitu, kun taas hemoglobiini ja myoglobiini ovat pentakoordinoituja. Tämä liittyy histidiiniaminohapon lähettämän aseman kanssa Hemo -ryhmän lähellä.
Neuroglobiini
Hänen löytönsä tehtiin vuonna 2000. Neuroglobiini on monomeeri, jolla on 150 aminohappoa, joten se on hyvin samanlainen kuin myoglobiini. Neuroglobiinin rakenteella on samankaltaisuus 21 - 25%: n välillä myoglobiinin ja hemoglobiinin kanssa.
Funktiot
Koska Globin ei ole yksin kehossa, vaan koska se on osa tiettyjä rakenteita, mainitaan toiminnot, jotka kukin heistä toteutetaan:
Hemoglobiini
Se sijaitsee punasolujen sisällä. Se vastaa hapen kiinnittämisestä ja kuljettamisesta keuhkoista kudoksiin. Samoin kuin hiilidioksidin runko, vastakkaisen reitin tekeminen.
Myoglobiini
Globiinissa sijaitsevan hemo -ryhmän tehtävänä on varastoida happimolekyylejä sydänlihaksen ja luurankojen happeamiseksi.
Sytoglobiini
Tämän proteiinin uskotaan vaikuttavan hypoksia- ja oksidatiivisten stressitilojen suojaamiseen kudoksissa. Uskotaan myös, että valtimoiden happi voi kuljettaa aivoihin.
Neuroglobiini
Uskotaan, että neuroglobiinilla on kyky korjata happea, monoksidia hiili- ja typpioksidi.
Seuroglobiinin toiminta ei kuitenkaan ole vielä tiedossa varmuudella, mutta uskotaan, että se liittyy hypoksia- ja aivo -iskemiaan säätelyyn. Erityisesti toimisi neuroprotektorina.
Voi palvella sinua: Lamarck TransformismoriateoriaKoska neuroglobiinilla on hemoglobiini ja myoglobiini samanlainen rakenne, arvataan, että se voisi osallistua hapen tarjontaan hermosolujen tasolla. Uskotaan myös, että se voi eliminoida vapaat radikaalit ja typen, joita esiintyy hengitysketjussa.
Typpioksidin suhteen sen ajatellaan eliminoivan sen, kun happi on normaalia ja tuottaa sen hypoksiaprosesseissa2.
Muutokset
Globiinin alfa- ja beetaketjut koodataan eri geeneihin, jotka sijaitsevat vastaavasti kromosomeilla 16 ja 11.
Henkilöillä, joilla on hemoglobiini (falciform tai drapanosyyttinen anemia), on vika globiinin beetaketjussa. Viat koostuu typpipohjojen korvaamisesta mukana olevan geenin nukleotidinumero 20: lla, missä Timin muuttuu adeniinin muutos.
P -geenin mutaatiots kromosomista 11 on peräisin Globinan eri puolia, nimeltään: Senegal, Kamerun, Benín, Bantú tai auto ja Aasian tai Arab-Intian.
Falkiformin anemiapotilaiden esittämien haplotyypin tyypin tunteminen on tärkeä epidemiologinen, koska se sallii tietää eri haplotyyppien jakautumisen, mutta myös tämä tieto tarjoaa tärkeitä tietoja taudin ennusteen tuntemiseksi.
Esimerkiksi: tiedetään, että Bantu -halotyyppi on vakavampi, kun taas Senegal ja Aasian tyyppi ovat lievempiä.
Haplotyypin ja toisen erot ovat hemoglobiinin F määrässä. Suurempi prosenttiosuus hemoglobiini F: stä ja alhaisemmasta hemoglobiinista on parempi ennuste. Vähemmän hemoglobiini F: tä ja enemmän hemoglobiinia huonompi ennuste.
Nämä mutaatiot perivät autosomisesti yhdessä hemoglobiinin mutaatioiden kanssa.
Viitteet
- "Globin." Wikipedia, ilmainen tietosanakirja. 19. lokakuuta 2018, 13:44 UTC. 11. heinäkuuta 2019, 17:26, Wikipedia.org
- ”Myoglobiini." Wikipedia, ilmainen tietosanakirja. 7. heinäkuuta 2019, 21:16 UTC. 11. heinäkuuta 2019, 20:42, Wikipedia.org
- Durán C, Morales O, Echeverri S, Isaza M. Beeta -globiinigeenihalotyypit hemoglobiinin kantajissa Kolumbiassa. Biolääketieteellinen 2012; 32: 103-111. Saatavana osoitteessa: Scielo.org
- Forrellat m, Hernández p. Neuroglobiini: Globinas -perheen uusi jäsen. Kuubalainen Rev Immunol Hemother 2011; 27 (3): 291-296. Saatavana osoitteessa: Scielo.SLD
- ”Sytoglobiini." Wikipedia, ilmainen tietosanakirja. 1. syyskuuta 2017, 17:26 UTC. 12. heinäkuuta 2019, 00:28 Wikipedia.org
- « Heteropolysakkaridien ominaisuudet, rakenne, toiminnot
- Paranoidinen skitsofreniaoireet, syyt ja hoidot »

