Heliohistoria, ominaisuudet, rakenne, riskit, käytöt

- 3214
- 924
- Gustavo Runte DVM
Hän helium Se on kemiallinen elementti, jonka symboli on. Tämä on ensimmäinen jalokaasu jaksollisessa taulukossa, ja se sijaitsee yleensä sen lopussa. Normaaliolosuhteissa se on inertti kaasu, koska mikään sen harvoista yhdisteistä ei ole vakaa; Se myös laajenee hyvin nopeasti ja on aine, jossa on pienin kiehumispiste.
Suositulla tasolla se on hyvin tunnettu kaasu, koska lukemattomissa tapahtumissa tai lastenjuhlissa se on yleistä. Se, mikä on todella ja ikuisesti kadonnut aurinkokunnan kulmiin, ja sen jälkeen, ne ovat heliumiatomit, jotka vapautetaan, kun maapallon on hajotettu.
 Heliumilla täydennetty ilmapallot, lähinnä tämä elementti jokapäiväisissä tilanteissa. Lähde: Pixabay.
Heliumilla täydennetty ilmapallot, lähinnä tämä elementti jokapäiväisissä tilanteissa. Lähde: Pixabay. Itse asiassa on niitä, jotka ja suurelta syystä uskovat, että heliumpallot edustavat tämän kaasun sopimattomia käytäntöjä. Onneksi sillä on tärkeämpiä ja mielenkiintoisempia käyttötarkoituksia sen fysikaalisten ja kemiallisten ominaisuuksien ansiosta, jotka erottavat sen muista kemiallisista elementeistä.
Esimerkiksi nestemäinen helium on niin kylmä, että se voi jäädyttää kaiken metalliseoksena, mikä tekee siitä suprajohtimen materiaalin. Se on myös neste, joka ilmenee superfluiditeetti, joka pystyy kiipeämään lasisäiliön seiniin.
Hänen nimensä on se, että hänet tunnistettiin ensin auringossa eikä maan päällä. Se on toiseksi runsain elementti koko maailmankaikkeudessa ja vaikka sen pitoisuus on naurettavaa maankuoressa, se voidaan saada maakaasun ja radioaktiivisten mineraalien varantoista uraanin ja toriumin varantoihin.
Täällä helium osoittaa toisen utelias tosiasian: se on kaasu, joka on paljon enemmän pohjalta kuin ilmakehässä, missä se lopulta pakenee maasta ja sen painovoimakentästä.
[TOC]
Historia
Heliumia ei löydetty maan päällä, vaan auringossa. Itse asiassa hänen nimensä on peräisin kreikkalaisesta sanasta 'Helios', joka tarkoittaa aurinkoa. Pelkästään elementin olemassaolo vastasi Dmitri Mendeléjevin jaksollista taulukkoa, koska uudelle kaasulle ei ollut paikkaa; Eli siihen mennessä jalokaasuista ei ollut mitään.
Nimi 'Helio', joka on kirjoitettu 'heliumiksi' englanniksi, päättyi siihen, että se viittaa siihen metalliksi; Juuri siksi, että toisen kaasun olemassaolo happea, vetyä, fluoria, klooria ja typpeä ei voida hyväksyä, lukuun ottamatta.
Tämän nimen on nimetty englantilainen tähtitieteilijä Norman Lockyer, joka tutki Englannista, mitä ranskalainen tähtitiede havaitsi.
Se oli siihen asti tuntemattoman elementin keltainen spektriviiva. Lockyer kertoi, että tämä johtui auringossa löydetyn uuden kemiallisen elementin läsnäolosta.
Vuonna 1895, melkein kaksikymmentä vuotta myöhemmin, skotlantilainen kemisti Sir William Ramsay tunnusti saman spektrin jäljellä olevasta kaasusta tutkiessaan radioaktiivista mineraalia: Cleveíta. Siksi täällä oli Helio.
Fysikaaliset ja kemialliset ominaisuudet
Ulkomuoto
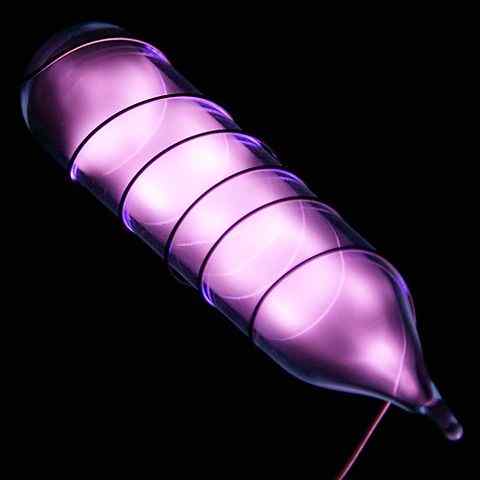 Ampulli heliuminäyte, joka paistaa sähköiskun jälkeen. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]
Ampulli heliuminäyte, joka paistaa sähköiskun jälkeen. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Helium on väritön, hajuton kaasu, jolla ei ole makua ja joka on myös inertti. Kuitenkin, kun sähköiski on levitetty, ja jännitealueesta riippuen, se alkaa loistaa kuin harmahtavan ja moraalinen sumu (ylempi kuva), paistaa sitten oranssilla hehkulla. Siksi heliumvalot ovat oransseja.
Atominumero (z)
2
Moolimassa
4,002 g/mol
Sulamispiste
-272,2 ºC
Kiehumispiste
-268,92 ºC
Tiheys
-0,1786 g/l normaaleissa olosuhteissa, ts.
-0,145 g/ml, sulamispisteessä, nestemäinen helium.
-0,125 g/ml, juuri kun helium alkaa kiehua.
-0,187 g/ml, 0 K: n ja 25 atm: n kohdalla, ts.
Kolminkertainen
2,177 K ja 5 043 kPa (0,04935 atm)
Kriittinen piste
51953 K ja 0,22746 MPa (22448 atm)
Sulamislämpö
0,0138 kJ/mol
Höyrystyslämpö
0,0829 kJ/mol
Molaarinen lämpökapasiteetti
20,78 J/(mol · k)
Höyrynpaine
0,9869 atm at 4,21 K. Tämä arvo antaa kuvan siitä, kuinka laivasto.
Ionisaatioenergiat
-Ensimmäinen: 2372,3 kJ/mol (hän+ kaasumainen)
-Toinen: 5250,5 kJ/mol (hän2+ kaasumainen)
Heliumin ionisaatioenergiat ovat erityisen korkeat, koska kaasuatomin on menetettävä elektroni, jolla on vahva tehokas ydinkuorma. Voidaan myös ymmärtää, otetaan huomioon, otetaan huomioon atomin pieni koko ja kuinka "sulje" ovat kaksi elektronia ytimen suhteen (niiden kahdella protonilla ja kahdella neutronilla).
Liukoisuus
Vedessä 0,97 ml on liuennut 100 ml vettä kohti 0 ºC: lla, mikä tarkoittaa, että se on vähän liukeneva.
Voi palvella sinua: ammoniumoksalaattiReaktiivisuus
Helium on luonnossa toinen vähiten reaktiivinen kemiallinen elementti. Normaaliolosuhteissa on onnistunut vakuuttamaan, että se on inertti kaasu; Koskaan (mitä se näyttää) voidaan manipuloida heliumyhdistettä huoneessa tai laboratoriossa ilman siihen vaikuttavia valtavia paineita; Tai ehkä, dramaattisesti korkeat tai matalat lämpötilat.
Esimerkki, jonka näemme NA -yhdisteessä2Hän, joka on stabiili vain 300 GPA: n paineessa, on tuotu timanttisolussa.
Vaikka kemialliset sidokset NA: ssa2On "muukalaisia", että niiden elektronit sijaitsevat hyvin kiteissä, ne ovat kaukana van der -seinien yksinkertaisista vuorovaikutuksista, ja siksi se ei vain koostu heliumiatomeista, jotka ovat loukussa molekyyliaggregaattien kanssa. Tässä on dilemma, jonka välillä heliumyhdisteet ovat todellisia ja jotka eivät.
Esimerkiksi typpimolekyylit korkeisiin paineisiin voivat vangita helium -atomin aiheuttamaan eräänlaisen rypäleen2-Ayksitoista.
Lisäksi on fullereenikationien endo -subveroivia komplekseja, c60 60+n ja c70+n, joiden onteloissa he voivat sijoittaa helium -atomeja; ja molekyylikationi heh+ (He-h+), löytyy erittäin kaukaisina sumuissa.
Hapetusnumero
Joka uteliaisuudesta yrittää laskea heliumin hapetusluvun millä tahansa sen yhdisteellä, huomaa, että tämä on yhtä suuri kuin 0. NA: ssa2Esimerkiksi hän voidaan ajatella, että hänen kaava vastaa hypoteettisia Na -ioneja2+Hän2-; Mutta sellainen olisi olettaa, että hänellä on puhdas ioninen luonne, kun todellisuudessa hänen linkkinsä ovat kaukana olemisesta.
Lisäksi Helium ei voita elektroneja, koska se ei pysty sijoittamaan niitä 2S -kiertoradan, ei käytettävissä olevaan energiaan; Ja ei myöskään ole mahdollista, että menetät ne atomin pienentymisen ja ytimen suuren tehokkaan ydinkuorman vuoksi. Siksi Helium osallistuu aina atomiin (teoriassa)0 - Johdettuissa yhdisteissä.
Elektroninen rakenne ja kokoonpano
Helium, kuten kaikki makroeskalassa havaitut kaasut, vie sen tallentavien säiliöiden tilavuuden, joten sillä on määrittelemätön tapa. Kuitenkin, kun lämpötila laskeutuu ja alkaa jäähtyä alle -269 ºC, kaasu tiivistyy värittömään nesteeseen; Helium I, ensimmäinen tämän elementin kahdesta nestefaasista.
Syy, miksi helium tiivistyy niin matalassa lämpötilassa, johtuu harvoista dispersiovoimista, jotka pitävät atominsa yhdessä; Riippumatta vaiheesta. Tämä voidaan selittää sen elektronisesta kokoonpanosta:
1s2
Jossa kaksi elektronia miehittää 1S -atomi -kiertoradan. Helium -atomi voidaan visualisoida melkein täydelliseksi palloksi, jonka homogeeninen elektroninen periferia ei ole kovin alttiita polarisoitumaan ytimen kahden protonin tehokkaan ydinkuorman avulla.
Siten spontaanit ja indusoidut dipolimomentit ovat harvinaisia ja erittäin heikkoja; Joten lämpötilan on lähestyttävä absoluuttista nollaa siten, että atomit ovat lähestyneet riittävää hitautta ja saavat niiden dispergoivat voimat määrittelemään nesteen; Tai vielä parempi, heliumilasi.
Dimeerit
Kaasumaisessa vaiheessa atomien erottaneella tilalla on sellainen, että voidaan olettaa, että yksi muista on aina erotettu. Niin paljon niin paljon, että rakkulassa, pienellä tilavuudella, helium näyttää värittömältä, kunnes siihen kohdistetaan sähköiski, joka ionisoi sen atomeja harmahtavan ja vähän kirkkaan sumua.
Nestemäisessä vaiheessa atomilla on kuitenkin jopa heikko vuorovaikutus, he eivät voi enää "sivuuttaa" pidemmän aikaa. Nyt dispersiovoima mahdollistaa heille2. Siksi voit ajatella Helium I: ta valtavina klustereina2 tasapainossa sen höyryvaihekatomien kanssa.
Siksi Helium I on niin vaikea erottaa sen höyryistä. Jos tämä neste vuototaan hermeettisen astiansa ulkopuolelta, se karkaa kuin valkeahko soihdutus.
Helio II
Kun lämpötila laskee vielä enemmän, koskettaen 2 178 K: ta (-270,972 ºC), tapahtuu vaihesiirto: Helium I muuttuu Helium II: ksi.
Tästä hetkestä lähtien kiehtovasta helium -nesteestä tulee tarpeeton tai kvanttiesine; toisin sanoen sen makroskooppiset ominaisuudet ilmenevät ikään kuin dimeerit2 He olivat yksittäisiä atomeja (ja ehkä he ovat). Siinä puuttuu täydellinen viskositeetti, koska ei ole pintaa, joka voi pysäyttää atomin liukumisen tai "kiipeilyn" aikana.
Siksi Helio II voi nousta lasisäiliön seinien läpi ylittäen painovoiman; Riippumatta siitä, kuinka korkeat ne ovat, niin kauan kuin pinta pysyy samassa lämpötilassa, ja siksi älä volisoi.
Se voi palvella sinua: Aivolisäkkeen happo (H3PO2): Ominaisuudet, käytöt ja reagenssitTämän vuoksi nestemäistä heliumia ei voida säilyttää lasisäiliöissä, koska se poistuu ennen pienintäkään halkeamaa tai porsaanreiää; Hyvin samanlainen kuin kuinka se tapahtuisi kaasulla. Sen sijaan ruostumatonta terästä käytetään näiden astioiden suunnittelussa (Dewars -säiliöt).
Kiteet
Vaikka lämpötila laski 0 K (absoluuttinen nolla), atomien välinen dispersiovoima, en olisi riittävän vahva tilaamaan niitä kiteiseen rakenteeseen. Jähmennystä varten paineen on noussut noin 25 atm; Ja sitten, kompaktit kuusikulmaiset kiteet ilmestyvät (HCP).
Geofysikaaliset tutkimukset osoittavat, että tämä HCP -rakenne pysyy ylivoimaisesti ennallaan, että paine nousee (Pascal Giga, GPA) saakka). Painekäyttökaaviossa on kuitenkin kapea alue, jossa nämä HCP-kiteet kärsivät siirtymästä kehoon keskittyvään kuutiofaasiin (BCC).
Missä se on ja saa
Kosmos ja kivet
 Helium edustaa maailmankaikkeuden toiseksi runsainta elementtiä ja 24% sen massasta. Lähde: Pxhere.
Helium edustaa maailmankaikkeuden toiseksi runsainta elementtiä ja 24% sen massasta. Lähde: Pxhere. Helium on toiseksi runsain elementti koko maailmankaikkeudessa, ja se on yli vety. Tähdet tuottavat jatkuvasti mittaamattomia määriä helium -atomeja sulauttamalla kaksi vetyydintä nukleosynteesiprosessin aikana.
Samoin kaikki radioaktiiviset prosessit, jotka emittoivat α -hiukkasia, on helium -atomien tuotantolähde, jos ne ovat vuorovaikutuksessa ympäristön elektronien kanssa; Esimerkiksi kallion rungon kanssa uraanin ja toriumin radioaktiivisten mineraalien säiliöissä. Nämä kaksi elementtiä kärsivät radioaktiivisesta rappeutumisesta, alkaen uraanista:
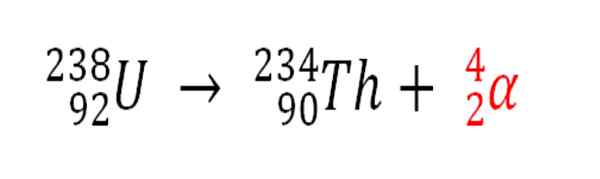 Radioaktiivinen rappeutuminen uraanissa Alfas -hiukkasten muodostumisessa, jotka myöhemmin muuttuvat helium -atomiin maanalaisissa kerrostumissa. Lähde: Gabriel Bolívar.
Radioaktiivinen rappeutuminen uraanissa Alfas -hiukkasten muodostumisessa, jotka myöhemmin muuttuvat helium -atomiin maanalaisissa kerrostumissa. Lähde: Gabriel Bolívar. Siksi kallioissa, joissa nämä radioaktiiviset mineraalit ovat väkevöityjä, heliumiatomit loukkuvat, mikä vapautuu, kun ne on sulatettu happamassa väliaineessa.
Joidenkin näistä mineraaleista ovat Cleveíta, Carnitita ja Uraniniitti, jotka kaikki koostuvat uraanioksideista (UO2 tai u3JOMPIKUMPI8) ja toriumin, raskasmetallien ja harvinaisten maametallien epäpuhtaudet. Maanalaisten kanavien kautta kasteltu helium voi päätyä kerääntymään maakaasusäiliöihin, mineraalilähteisiin tai meteorisiin silitysrautaan.
Arvioidaan, että vuosittain tuotetaan heliumimassa, joka vastaa 3000 tonnia, uraanin ja toriumin radioaktiivisesta rappeutumisesta.
Ilma- ja meri
Helium ei ole kovin liukoinen veteen, niin aikaisemmin kuin myöhemmin se nousee syvyyksistä (missä sen alkuperää löytyy), ilmakehän kerrosten ylittämiseksi ja lopulta Sidereal Space -sovelluksen saavuttamiseksi. Sen atomit ovat niin pieniä ja kevyitä, että maan gravitaatiokenttä ei voi pitää niitä ilmakehässä.
Edellä esitetyn vuoksi heliumin pitoisuus sekä ilmassa (5,2 ppm) että merillä (4 ppt) on erittäin matala.
Jos halusit poimia jostakin näistä kahdesta mediasta, "paras" vaihtoehto olisi ilma, jonka on ensin lähetettävä se nesteyttämiseen kaikkien komponenttien kaasujen tiivistämiseksi, kun taas helium pysyy kaasumaisessa tilassa.
Heliumin saaminen ilmasta ei kuitenkaan ole käytännöllistä, vaan radioaktiivisilla mineraaleilla rikastuneista kivistä; tai vielä parempaa, maakaasuvarantoja, joissa helium voi edustaa jopa 7% sen kokonaismassaan.
Maakaasun nesteyttäminen ja tislaus
Ilman alistamisen sijasta se on helpompaa ja kannattavampaa. Siten heliumin saamiseksi raaka -aineen par excellence (kaupallinen) on maakaasu, joka voidaan myös toimittaa murto -distraatioon.
Tislauksen lopputuote on viimeistelty puhdistuksesta aktivoidulla hiilellä, joka kulkee suuren puhtauden heliumin läpi. Ja lopuksi helium erottuu neonista kryogeenisen prosessin kautta, jossa käytetään nestemäistä heliumia.
Isotoopit
Helium esitetään luonnossa pääosin isotooppina 4Hän, jonka alasti ydin on kuuluisa hiukkanen a. Tämä atomi 4Minulla on kaksi neutronia ja kaksi protonia. Vähemmän runsaus on isotooppi 3Hän, jolla on vain yksi neutroni. Ensimmäinen on raskaampi (sillä on suurempi atomimassa) kuin toinen.
Siten isotooppipari 3Hän ja 4On niitä, jotka määrittelevät kipeät ominaisuudet ja mitä ymmärrämme heliumista kemiallisena elementtinä. Sen jälkeen kun 3Hän on kevyempi, oletetaan, että heidän atomeillaan on enemmän kineettistä energiaa ja että he tarvitsevat vielä alhaisemman lämpötilan yhtenäiseksi tarpeetonta.
Hän 3Olen pitänyt hyvin harvinaisen lajin täällä maan päällä; Kuukon maaperässä sitä on kuitenkin runsaampaa (noin 2000 kertaa). Siksi kuu on altistunut projektien ja tarinoita mahdollisena lähteenä 3Hän, jota voidaan käyttää ydinpolttoaineena tulevaisuuden avaruusalukselle.
Voi palvella sinua: puhtaat aineetMuiden helium -isotooppien joukossa voidaan mainita niiden vastaavilla puoliikäisillä aikoilla: 5Hän (t1/2= 7,6 · 10−22 s), 6Hän (t1/2= 0,8 s) ja 8Hän (t1/2= 0,119 s).
Riskejä
Helium on inertti kaasu, joten se ei osallistu mihinkään kehomme sisällä tapahtuviin reaktioihin.
Sen atomit pääsevät käytännössä ja uloshengitetään ilman niiden vuorovaikutusta biomolekyylien kanssa, jotka tuottavat seuraavaa vaikutusta; Lukuun ottamatta ääniä, jotka ovat akuuttisia ja joilla on enemmän taajuutta.
Ihmiset, jotka hengittävät ilmapalloa (maltillisesti), puhuvat akuutilla äänellä, samanlainen kuin orava (tai ankka).
Ongelma on siinä tosiasiassa, että jos mainittu henkilö hengittää sopimattoman määrän heliumia, tukahduttavien ajojen riski, koska heidän atomit siirtyvät happimolekyyleihin; Ja siksi se ei pysty hengittämään ennen kuin kaikki helium hengittää, mikä puolestaan paineesta johtuen voi repiä keuhkokudoksen tai aiheuttaa barotraumoja.
Inhale Heliosta kuolleista ihmisistä on ilmoitettu vasta selitettyjen takia.
Toisaalta, vaikka se ei edusta paloriskiä, koska sen reaktiivisuuden puute happea (tai muuta ainetta), jos sitä säilytetään korkeissa paineissa ja pakenee, sen poistuminen voi olla fyysisesti vaarallista.
Sovellukset
Helion fysikaaliset ja kemialliset ominaisuudet eivät vain tee siitä erityistä kaasua, vaan myös erittäin hyödyllistä ainetta sovelluksille, jotka ansaitsevat lämpötilan erittäin alhaisina. Tässä osassa käsitellään joitain näistä sovelluksista tai käyttötarkoituksista.
Paine- ja puhdistusjärjestelmät
Joissakin järjestelmissä on tarpeen lisätä painetta (paineista), ja tätä varten se on injektoitava tai tarjonta, joka ei ole vuorovaikutuksessa minkään sen komponentin kanssa; Esimerkiksi reagensseilla tai pinnoilla, jotka ovat herkkiä ei -toivotuille reaktioille.
Siten painetta voidaan nostaa heliumtilavuuksilla, joiden kemiallinen hitaus tekee siitä ihanteellisen tähän tarkoitukseen. Inertti ilmapiiri, joka helpottaa, ylittää tietyissä typen tapauksissa.
Käänteinen prosessi, ts. Puhdistus, heliumi. Tällä tavoin järjestelmän paine vähenee, kun helium on tyhjennetty.
Vuotojen havaitsemat
Helium voidaan suodattaa pienimmän halkeaman läpi, joten se myös havaitsee putkien vuotojen, korkean värähdyksen astiat tai kryogeeniset säiliöt.
Joskus havaitseminen voidaan tehdä visuaalisesti tai kosketuksella; Enimmäkseen ilmaisin on se, mikä "heittää" signaalin siitä, missä ja kuinka paljon heliumia pääsee tarkastuksessa olevasta järjestelmästä.
Vetää kaasua
Helium -atomit, kuten puhdistusjärjestelmille mainittiin, voivat vetää sitä painostasi riippuen, raskaammat molekyylit. Esimerkiksi tätä periaatetta käytetään päivittäin kaasukromatografiaanalyysissä, koska se voi vetää näytteen sukulaiseen pylvään pitkin, missä se on vuorovaikutuksessa paikallaan olevan vaiheen kanssa.
Ilmapallot ja ilmalaivat
 Heliumia käytetään ilma -alusten täyttämiseen ja se on paljon turvallisempaa kuin vety, koska se ei ole syttyvä kaasu. Lähde: Pixabay.
Heliumia käytetään ilma -alusten täyttämiseen ja se on paljon turvallisempaa kuin vety, koska se ei ole syttyvä kaasu. Lähde: Pixabay. Alhaisen tiheyden vuoksi ilmassa verrattuna ja jälleen sen reaktiivisuuden puuttumiseen hapen kanssa, sitä on käytetty lastenpuolueiden ilmapallojen paisuttamiseen (sekoitettuna happea niin, että ketään ei tukahduta hengitystä varten) ja ilmalaivojen (ylivoimainen kuva) , pystymättä edustamaan tulipalon riskiä.
Sukeltaa
 Helium on yksi happea säiliöiden pääkomponenteista, joiden kanssa sukeltajat hengittävät. Lähde: Pxhere.
Helium on yksi happea säiliöiden pääkomponenteista, joiden kanssa sukeltajat hengittävät. Lähde: Pxhere. Kun sukeltajat laskeutuvat suurempiin syvyyksiin, niiden on vaikea hengittää veden aiheuttaman suuren paineen seurauksena. Siksi Helio lisätään happisäiliöihinsä kaasun tiheyden vähentämiseksi, joita sukeltajat hengittävät ja hengittävät, ja siten se voidaan ulos.
Kaarihitsaus
Hitsausprosessissa sähkökaari tuo tarpeeksi lämpöä siten, että kaksi metallia liitetään. Jos hehkulamppuinen metalli suoritetaan heliumin ilmakehän alla, se ei reagoi ilman hapen kanssa sen vastaavaksi oksidiksi; Siksi helium estää tämän tapahtuvan.
Suprajohteet
 Nestemäistä helium. Lähde: Jan Ainali [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]
Nestemäistä helium. Lähde: Jan Ainali [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Nestemäinen helium on niin kylmä, että se voi jäädyttää metallit muuttamaan ne suprajohteiksi. Tämän ansiosta on valmistettu erittäin tehokkaita magneetit, joita nestemäisellä heliumilla on käytetty kuvissa tai ydinmagneettiresonanssin kuvista tai spektrometreistä.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Andy Estance. (17. huhtikuuta 2019). Helium -hydridi -ioni havaittiin avaruudessa ensimmäistä kertaa: todisteet, jotka löydettiin vaikeasta kemiasta maailmankaikkeuden ensimmäisistä minuutteista. Toipunut: ChemistryWorld.com
- Peter Wothers. (19. elokuuta 2009). Helium. Kemia sen elementissä. Toipunut: ChemistryWorld.com
- Wikipedia. (2019). Helium. Haettu: vuonna.Wikipedia.org
- Mao, h. K -k -., Wu, ja., Jephcoat, a. P., Hemley, r. J -., Bell, P. M., & Bassett, W. -Lla. (1988). Kristallirakenne ja heliumin tiheys jopa 232 kbariin asti. Haettu: artikkelit.Adsabs.Harvard.Edu
- Kansallinen bioteknologiatietojen keskus. (2019). Helium. Pubchem -tietokanta. CID = 23987. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Mary-Ann Muffoletto. (6. helmikuuta 2017). Ylös, ylös ja pois: kemistit sanovat 'kyllä', helium voi muodostaa yhdisteitä. Utahin osavaltion yliopisto. Toipunut: Phys.org
- Steve Gagnon. (S.F.-A. Elementin heliumin isotoopit. Jefferson Lab. Toipunut: Koulutus.JLAB.org
- Advameg, Inc. (2019). Helium. Palautettu: Chemistry Explaed.com

