Hemoolisiini -ominaisuudet, tyypit, toimintamekanismit
- 771
- 206
- Louis Moen
Se Hemoolisiini Se on pieni proteiini, joka aiheuttaa huokoset punasolujen solumembraaniin ja joihinkin muihin nisäkkäiden veren soluihin. Patogeeniset bakteerit syntetisoivat sen yleensä ja erittyvät.
Tämä proteiini on yksi yleisimmistä mikrobitoksiinista ja sitä, jota on parhaiten tutkittu. Joskus se voi aiheuttaa hemolyyttistä anemiaa, koska kanavien määrä, joiden kautta solujen sisustus tulee, voi jopa aiheuttaa solujen hajoamista.
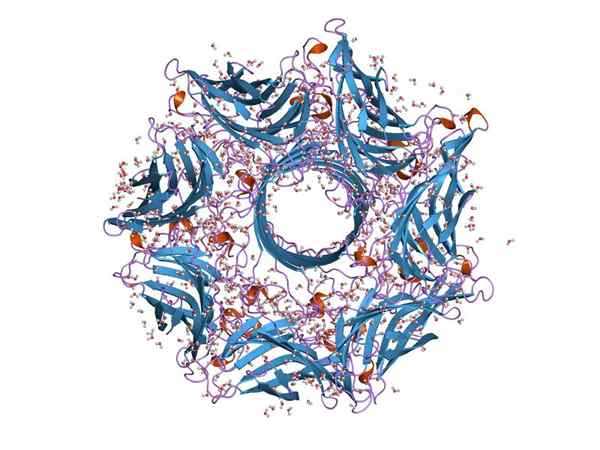
 Hemoolisiinin molekyylirakenne (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue] Wikimedia Commonsin kautta)
Hemoolisiinin molekyylirakenne (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue] Wikimedia Commonsin kautta) Yleensä hemoolisiini on tyypillinen toksiinin lajit Streptokokki suolistoa. Sen toiminta antaa bakteereille rikkoa suoliston epiteeliesteen ja liikkua siten verenkierron läpi muiden kudosten kolonisoimiseksi.
Yleisin tapa, jolla hemoolisiinia löytyy luonnossa, on sen a-hemolisiinin muodossa. Tämä proteiini on yksi useimpien kantojen tärkeimmistä virulenssitekijöistä Escherichia coli Ja jotkut Clostrides.
Suurin osa virtsatieinfektioista johtuu Escherichia coli jotka tuottavat α-hemolisiinin hemolyyttisiä ominaisuuksia.
Hemoolisiini- ja bakteriosiinin tuotanto on liittynyt bakteerikannoihin, joilla on pätevyysmekanismi muita lajeja vastaan, ja molempien toksiinien tuotanto näyttää riippuvan samoista geneettisistä tekijöistä bakteerien genomissa.
[TOC]
Ominaisuudet
Hemoolisiini muodostuu seitsemästä alayksiköstä ja sitä koodaavalla geenillä on seitsemän promoottoria. Nämä seitsemän alayksikköä asetetaan valkoisten solujen plasmamembraaniin ja yhdessä yhdessä ne muodostavat ionisen kanavan, jossa solun sisätilan metaboliitit poistuvat.
Hemoolisiini on kalsiumista riippuvainen sytotoksiinia (CA+2) solunulkoista, joka vaikuttaa veren torrent -solujen plasmamembraaniin. Membraaniin luovat huokoset ovat myös hydrofiilisiä ja aiheuttavat veden pääsyn solujen sisäosaan, mikä voi aiheuttaa hajoa.
Se voi palvella sinua: Unporto: Kuljetus kalvojen läpi, ominaisuudetHemoolisiinit ovat proteiinituotteita, jotka ovat tyypillisiä gram-negatiivisille tyyppisille bakteereille, ja kaikilla on kaksi ominaisuutta:
1- Toistuvan glysiinin ja asparagiinihapon muodostettu hyvin pienen peptidin (nonapéptid) läsnäolo. Hemoolisiini nonpapéptides sijaitsee lähellä primaarisen proteiinirakenteen C-terminaalista osaa.
2- Kaikki hemoolisiinit erittyvät bakteerilla solunulkoiseen väliaineeseen ABC-tyyppisen kuljettajan kautta (englanninkielisestä ATP: tä sitovasta kasetista).
Hemoolisiinit havaitaan yleensä bakteerikannoilla kasvun kautta veren agarin keskellä. Testissä havaitaan hemolyyttinen halo, punasolujen repeämän tuote lähellä bakteerien pesäkkeitä.
Kaverit
Hemoolisiineja on useita erityyppisiä, ne luokitellaan kreikkalaisella kirjaimella heidän nimensä alussa. Tutkituimpia ja yleisiä ovat a-, β- ja y -hemoolisiinit, kaikki tuottavat kantaa Staphylococcus aureus.
Hemoolisiinityypit luokitellaan hyökkäävien solualueen mukaan ja niiden primaarisen proteiinirakenteen mukaan.
α-hemolisiini
Tämä proteiini on tyypillinen Staphylococcus aureus ja Escherichia coli; Hyökkää neutrofiilejä, punasoluja, lymfosyyttejä, makrofageja, aikuisia ja alkion fibroblasteja. Vuorovaikutuksessa näiden solujen plasmamembraanilipidien polaaristen pään kanssa, kunnes internalisoivat noin 5 ӑ: n hydrofobisen hännän kalvon sisällä.
β-hemolisiini
Tuottanut Staphylococcus aureus Pienempaan osaan kuin a-hemolisiini, β-hemolisiini hyökkää pääasiassa punasoluihin ja on sisäinen kalvossa yksinomaan rikkaiden domeenien kautta solumembraanin spingomyelineen kautta.
γ-hemolisiini
Sitä on havaittu myös Staphylococcus aureus. Se on luokiteltu hemolyyttiseksi proteiiniksi ja leukotoksiiniksi samanaikaisesti, koska se vaikuttaa ihmisten, monosyyttien, makrofagien ja harvoin, jopa punaisten verisolujen polymorfonukleaarisiin soluihin.
Tämän tyyppinen y-hemolisiini on yksi vähiten karakterisoidusta, joten suuri osa sen vaikutustapausta on ollut tiedossa, eikä tätä ole tutkittu In vivo.
Voi palvella sinua: Osteoblastit: Koulutus, ominaisuudet, toiminnot, patologiatToimintamekanismit
Suhteellisen selvä vaikutusmekanismi on a-hemolisiini. Koska kaikki ovat hemolyyttisiä proteiineja, ajatellaan, että suurin osa prosesseista on yleistä kaikille hemolysiineille.
Tutkijat viittaavat siihen, että bakteerien osalta he erottelevat hemoolisiinin ympäristöön, jonka heidän on oltava ravintoaineiden mikroympäristössä, siksi tämä olisi mekanismi, joka laukaisee solun tuhotakseen valkoiset solut ja saadakseen ravinteensa ravinteitaan ja saada ravinteitaan heidän ravinteitaan ja ravinteitaan saada.
Mekanismi on kuvattu kolmessa vaiheessa: liitto solukalvoon, insertio ja oligomerointi.
Kalvoliitto
On havaittu, että hemoolisiinit voivat liittyä neutrofiilien integriineihin ja punasoluissa on havaittu, että nämä proteiinit sitoutuvat glykosyloituihin komponentteihin, kuten glykoproteiineihin, gangliasideihin ja solukalvojen glyforiineihin.
Jotkut kirjoittajat viittaavat siihen, että reseptoreiden läsnäolo kalvossa ei ole välttämätöntä hemolysiinien liiton esiintyessä. Joka tapauksessa soluproteiinin mekanismia ei vielä tunneta tarkasti.
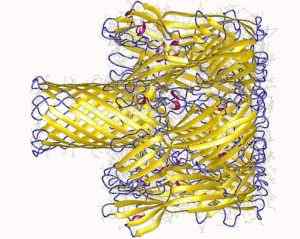 Staphylococcus -hemoolisiiniproteiinin muodostama transmembraniaalinen huokos (lähde: Laskutuskirjailijat: Song, L., Hobaugh, m., Shstak, c., Cheley, s., Bayley, H., Gouaux, J.JA.; Visualisointi Tekijä: Käyttäjä: Astrojan [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Wikimedia Commonsin kautta)
Staphylococcus -hemoolisiiniproteiinin muodostama transmembraniaalinen huokos (lähde: Laskutuskirjailijat: Song, L., Hobaugh, m., Shstak, c., Cheley, s., Bayley, H., Gouaux, J.JA.; Visualisointi Tekijä: Käyttäjä: Astrojan [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Wikimedia Commonsin kautta) Vuorovaikutus kalvon kanssa tapahtuu kahdessa vaiheessa:
- Alkuperäinen liitto (palautettavissa): Kun hemoolisiini sitoutuu kalvon kalsiumliittodomeeneihin. Tämä vaihe tapahtuu pinnalla ja on erittäin herkkä sähköstaattisille päästöille.
- Peruuttamaton liitto: Varaa aminohappodomeenit valkoisten solujen plasmamembraanin lipidikomponenttien kanssa fyysisten ammattiliittojen muodostamiseksi kalvon hydrofobisten yhdisteiden välillä.
Voi palvella sinua: soluseinäToksiinin asettaminen kalvoon
Α-hemolisiini insertoi jätteet 177 ja 411 ensimmäisessä lipidikerroksessa. Solunulkoisessa väliaineessa hemoolisiini liittyy kalsiumioneihin, jotka indusoivat tässä rakennejärjestelyn ja edistävät sen aktivointia.
Tämä lisäys yhdistää peruuttamattoman liiton solukalvoon. Kun järjestely on tapahtunut, hemoolisiinista tulee olennainen proteiini, koska kokeellisesti on osoitettu, että ainoa tapa purkaa se kalvosta on käyttämällä pesuaineita, kuten Triton X-100.
Oligomerointi
Kun kaikki hemoolisiini on asetettu valkoisen solun plasmamembraaniin.
On havaittu, että oligomerointiprosessia suositaan solukalvon mikrodominiumit tai lipidibalsas. Nämä alueet eivät välttämättä suosittele proteiinin liitosta, mutta ne suosivat sen jälkeen, kun se on asetettu.
Mitä enemmän hemoolisiineja sitoutuvat kalvoon, sitä suurempi huokosten määrä muodostuu. Lisäksi hemoolisiinit voivat oligomerisoida toistensa kanssa (vieressä) ja muodostaa paljon suurempia kanavia.
Viitteet
- Bakás, l., Ostolaza, H., Vaz, W. Lens., & Goñi, f. M. (1996). Escherichia coli -alfa-hemolysiinin palautuva adsorptio ja päinvastainen lisäys lipidikerroksiksi. Biophysical Journal, 71 (4), 1869-1876.
- Dalla Serra, M., Coraiola, m., Viero, G., Comai, m., Potrich, c., Ferreras, m.,… & Prévot, g. (2005). Staphylococcus aureus -komponentti y-hemolysiinit, HLGA, HLGB ja HLGC voivat sekoittaa kaikkien komponenttien laskemiseen. Journal of Chemical Information and Modeling, 45 (6), 1539-1545.
- Gow, J. -Lla., & Robinson, J. (1969). Puhdistetun stafylokokkien P-hemolysiinin ominaisuudet. Journal of Bacteriology, 97 (3), 1026-1032.
- Ike, ja., Hashimoto, H., & Clewell, D. B -. (1984). Streptococcus faecalis -lajien hemolysiini zymogenes, jonka edistät virulenssia hiirissä. Infektio ja immuniteetti, 45 (2), 528-530.
- Remington, J. S., Klein, J. JOMPIKUMPI., Wilson, c. B -., Nizet, v., & Maldonado, ja. -Lla. (Toim.-A. (1976). Sikiön ja vastasyntyneen tarttuvat aavikot (Vol. 4). Philadelphia: Saunders.
- Todd, e. W -. (1932). Antigeeninen streptokokki hemolysiini. Journal of Experimental Medicine, 55 (2), 267-280.
- « Pietrain alkuperä, ominaisuudet, ruoka, lisääntyminen
- Venttiilien ominaisuudet, histologia, toiminnot »

