Heksokinaasirakenteet, toiminnot, muodot
- 1135
- 226
- Shawn Stanton II
Se Heksokinaasi (HK) on entsyymi, joka katalysoi glykolyyttisen reitin ensimmäistä reaktiota käytännössä kaikissa elävissä organismeissa, sekä prokaryooteissa että eukaryooteissa. Se on vastuussa fosforyyliryhmän siirtämisestä glukoosiin, tuottaen glukoosi-6P: tä, vaikka se voi myös fosforyloida muita heksikäs sokeria (6 hiiliatomia).
Tämä entsyymi luokitellaan toiseen kahdesta glukoosikinaasientsyymien perheistä (entsyymit, jotka siirtävät fosforyyliryhmiä substraateihin, kuten glukoosi): heksakinaasiperhe (HK), jonka jäsenet on jaettu kolmeen eri ryhmään, jotka tunnetaan nimellä HK -ryhmä, The HK -ryhmä, Ryhmä A ja ryhmä B.
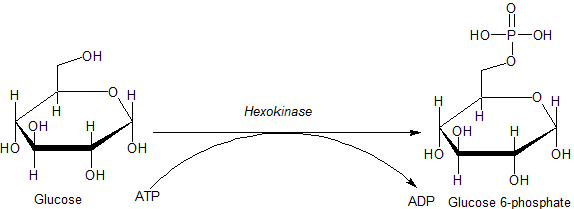
 Heksokinaasientsyymin katalysoima reaktio (lähde: JMUN7616 [julkinen alue] Wikimedia Commonsin kautta)
Heksokinaasientsyymin katalysoima reaktio (lähde: JMUN7616 [julkinen alue] Wikimedia Commonsin kautta) HK -perheeseen kuuluville entsyymeille on ominaista glukoosifosforylaatio ATP: n kustannuksella fosforyyliryhmän luojamolekyylinä, ja samanlaiset eroavat toisistaan pääasiassa niiden molekyylipainon ja substraattispesifisyyden suhteen.
HK-ryhmä kuuluu eukaryoottisten organismien entsyymeihin (ATP: D: D-heksoosi 6-fosfotransferaasit), sillä välin ryhmä A edustaa gram-negatiivisten bakteerien entsyymejä, syanobakteereja, amitisoituneita ja tripanosomatidiaalisia protisteja, ja ryhmä B sisältää grammin entsyymit -positiiviset bakteerit ja creanarqueotas -organismit.
Ryhmien A ja B entsyymit tunnetaan myös nimellä glykokinaasit (GLCKS), koska ne kykenevät yksinomaan glukoosifosforylaatioon, minkä vuoksi näitä entsyymejä kutsutaan ATP: D-glukoosi 6-fosfotransferaasi.
Glykolyyttisenä entsyyminä heksokinaasilla on suuri metabolinen merkitys, koska ilman sitä tämä tärkeä reitti ei olisi mahdollista ja soluilla, jotka ovat erittäin riippuvaisia hiilihydraattien kulutuksesta, kuten esimerkiksi monien nisäkkäiden aivoilla ja lihassoluilla, olisi vakavia toiminnallisia ja fysiologisia esteitä koskevia esineitä. yleensä.
[TOC]
Rakenne
Kuten myöhemmin nähdään, nisäkkäissä ja muissa selkärankaisissa (samoin kuin yksisoluisissa organismeissa, kuten hiivoissa) on erityyppisiä heksokinaasientsyymejä. Nisäkkäissä neljä on kuvattu: isoformit I, II, III ja IV.
Voi palvella sinua: rautaseokset: ominaisuudet, tyypit, esimerkitKolmella ensimmäisellä isoentsyymillä on 100 kDa molekyylipaino, mutta isoentsyymi IV on 50 kDa. Näillä isoentsyymeillä (etenkin I-III) on suuri samankaltaisuus heidän välillä.
Näiden entsyymien N-terminaalista domeenia pidetään ”säätimen” domeenina, kun taas katalyyttistä aktiivisuutta suorittaa C-terminaalinen domeeni (nisäkkäiden HK II: n aktiiviset kohdat molemmissa domeeneissa).
N-terminaalinen domeeni on kytketty C-terminaaliseen domeeniin alfa-potkurin kautta, jokaisella on noin 50 kDa: n molekyylipaino ja siinä on glukoosin risteys.
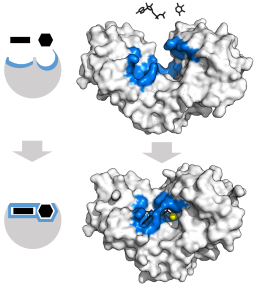 Indusoitu säätömalli heksakinaasientsyymille (suhteessa sen kahteen substraattiin: ATP ja glukoosi) (lähde: Thomas Shafee [CC 4: llä.0 (https: // creativecommons.Org/lisenssit/by/4.0)] Wikimedia Commonsin kautta)
Indusoitu säätömalli heksakinaasientsyymille (suhteessa sen kahteen substraattiin: ATP ja glukoosi) (lähde: Thomas Shafee [CC 4: llä.0 (https: // creativecommons.Org/lisenssit/by/4.0)] Wikimedia Commonsin kautta) Näiden entsyymien tertiäärinen rakenne koostuu olennaisesti β-sijoitetuista levyistä sekoitettuna alfa-potkurien kanssa, joiden osuus vaihtelee suhteessa entsyymiin ja kyseisiin lajeihin; ATP: n ammattiliitto, toinen heksokinaasisubstraatti, koostuu yleensä viidestä P -levystä ja kahdesta alfa -potkurista.
Funktiot
Heksokinaasilla on transsendenttinen toiminta hiilihydraattien aineenvaihdunnassa useimpien elävien olentojen suhteen, koska katalysoi glykolyyttisen reitin ensimmäisen vaiheen, välittäen glukoosin fosforylaatiota sisällä.
Tämä glykolyysin ensimmäinen vaihe, joka koostuu fosforyyliryhmän siirrosta ATP: stä (luovuttaja) glukoosiin, joka antaa 6-fosfaatin ja ADP-glukoosin, on ensimmäinen kahdesta energiainvestointivaiheesta ATP: n muodossa.
Lisäksi heksokinaasin katalysoima reaktio on glukoosin "aktivoinnin" läpäisy myöhemmälle prosessoinnille ja edustaa "sitoutumisen" vaihetta, koska glukoosi siis fosforyloitu ei voi jättää solua tavanomaisten kuljettajiensa läpi membraaniplasmassa.
Voi palvella sinua: heterogeeniset seoksetHeksokinaasin katalysoiman reaktion tuote, toisin sanoen 6-fosfaattihien glukoosi, on haara, koska se on ensimmäinen substraatti, jota käytetään pentoosifosfaatin reitillä ja glykogeenin synteesissä monissa eläimissä (ja niistä kasvien tärkkelys).
Kasveissa
Heksokinaasin toiminta kasveissa ei ole kovin erilainen kuin eläinten tai mikro -organismien toiminta, mutta ylemmissä kasveissa tämä entsyymi toimii myös sokerikonsentraation "anturina".
Tämän toiminnon merkitys näissä organismeissa liittyy sokerien osallistumiseen säätelytekijöiksi geenien ilmentymisessä, jotka ovat mukana erilaisissa aineenvaihduntaprosesseissa, kuten:
- Fotosynteesi
- Glioksylaattisykli
- Hengitys
- Tärkkelyksen ja sakkaroosin hajoaminen tai synteesi
- Typen metabolia
- Puolustus taudinaiheuttajia vastaan
- Solusyklin säätely
- Parantava vastaus
- Pymentointi
- Vanheneminen muun muassa.
Tämä heksokinaasin funktio "anturina" solunsisäisen glukoosin määrästä on kuvattu myös hiivoille ja nisäkkäille.
Muodot
Luonnossa on erilaisia heksakinaasien muotoja, ja tämä riippuu pohjimmiltaan lajeista, joita harkitaan.
Esimerkiksi ihmisen ja muiden selkärankaisten eläimissä on osoitettu 4 erilaisen heksakinaasientsyymin isolomuodon olemassaolo, joihin se on merkitty roomalaisten lukujen I, II, III ja IV kanssa.
II-isoentsyymit, II ja III ovat 100 kDa: n molekyylipaino, ne estävät niiden reaktiotuotteen (6-fosfaattiglukoosi) ja liittyvät hyvin glukoosiin, ts. Niillä on erittäin matala KM-vakio. Näillä entsyymeillä ei kuitenkaan ole juurikaan substraatin spesifisyyttä, koska ne kykenevät fosforyloimaan muita heksosoja, kuten fruktoosia ja kättä.
Voi palvella sinua: hapot: ominaisuudet ja esimerkitIV -isoentsyymi IV: llä, joka tunnetaan myös nimellä glykokinaasi (GLCK), on vain 50 kDa: n molekyylipaino ja huolimatta siitä, että se on vähän liittynyt (korkeat KM -arvot), sillä on suuri spesifisyys glukoosilla substraattina, eikä sitä sovelleta niitä säätelymekanismeihin, joita toinen toinen kolme isoentsyymiä.
Monien nisäkkäiden heksokinaasin glukokinaasi (isoentsyymi IV) löytyy pääasiassa maksasta ja auttaa tätä elintä sen glukoosin kulutusnopeuden "säätämisessä" tämän substraatin vaihteluihin kiertävässä veressä.
Kolme geeniä, jotka koodaavat heksokinaaseille I, II ja III eläimissä, näyttävät III: n olevan vain C-terminaalisessa päässä.
Viitteet
- Aronoff, S. Lens., Berkowitz, k., Shreiner, b., & Halua, l. (2004). Glukoosimetabolia ja säätely: Insuliinin ja glukagonin ulkopuolella. Spektrin diabetes, 17(3), 183-190.
- Harrington, G. N., & Bush, D. R -. (2003). Heksokinaasin bifuncional rooli aineenvaihdunnassa ja glukoosin signaloinnissa. Kasvisolu, viisitoista(11), 2493-2496.
- Jang, J. C., León, P., Zhou, l., & Sheen, J. (1997). Heksokinaasi sokerianturin suhteen korkeammilla kasveilla. Kasvisolu, 9(1), 5-19.
- Kawai, s., Mukai, t., Mori, S., Mikami, b., & Murata, K. (2005). Hypoteesi: Heksakinaasiperheen glukoosikinaasien rakenteet, evoluutio ja esi -isä. Journal of Bioscience and Bioinsingineering, 99(4), 320-330.
- Mathews, k. JA. (1998). Pakettiauto. Biokemia.
- Wilson, J. JA. (2003). Nisäkkäiden heksakinaasin isotsyymit: rakenne, solunsisäinen lokalisointi ja metabolinen toiminta. Journal of Experimental Biology, 206(12), 2049-2057.
- « 13 mehua gastriitin parantamiseksi (luonnollinen ja tehokas)
- Erilaiset evoluution syyt ja esimerkit »

