Hiilihybridisaatiokonsepti, tyypit ja niiden ominaisuudet
- 1991
- 146
- Dr. Travis Reichert
Se hiilihybridisaatio Se merkitsee kahden puhtaan atomin orbitaalin yhdistelmää uuden "hybridi" -molekyylin kiertoradan muodostamiseksi omilla ominaisuuksilla. Atomien kiertoradan käsite antaa paremman selityksen kuin edellinen kiertorata käsite, jotta voidaan määrittää likiarvo siitä, missä todennäköisemmin löytyy elektronia atomiin.
Toisin sanoen atomiorbitaali on kvanttimekaniikan esitys, joka antaa kuvan elektronin tai elektroniparin sijainnista tietyllä atomin alueella, missä kukin kiertorata määritellään sen arvojen mukaan Numerot Quantum.

Kvanttinumerot kuvaavat järjestelmän tilaa (kuten atomin sisällä oleva elektroni) tietyllä hetkellä elektroniin (n), joka kuuluu sen liikkeessä (L), liittyvän magneettisen momentin (m), joka kuuluu elektroniin (n), kautta (n) (m) ja elektroni kääntyy liikkuessa atomin sisällä.
Nämä parametrit ovat ainutlaatuisia jokaiselle kiertoradalla olevalle elektronille, joten kahdella elektronilla ei voi olla täsmälleen samoja arvoja neljästä kvanttiluvusta ja kukin kiertoradalla voidaan käyttää kaksi elektronia korkeintaan elektronissa.
[TOC]
Mikä on hiilihybridisaatio?
Hiilihybridisaation kuvaamiseksi on otettava huomioon, että kunkin kiertoradan ominaisuudet (sen muoto, energia, koko jne.) riippuvat jokaisella atomilla olevasta elektronisesta kokoonpanosta.
Toisin sanoen kunkin kiertoradan ominaisuudet riippuvat elektronien sijoittamisesta jokaisessa ”kerroksessa” tai tasolla: lähinnä ytimestä uloimpaan, tunnetaan myös nimellä Valencia -kerros.
Voi palvella sinua: Natrium: Historia, rakenne, ominaisuudet, riskit ja käyttötarkoituksetUlkoisimmat tason elektronit ovat ainoat käytettävissä linkin muodostamiseksi. Siksi, kun kemiallinen sidos muodostuu kahden atomin väliin, syntyy kahden kiertoradan päällekkäisyys tai päällekkäisyys (yksi atomista) ja tämä liittyy läheisesti molekyylien geometriaan.
Kuten edellä todettiin, jokainen kiertorata voidaan täyttää korkeintaan kahdella elektronilla, mutta Aufbaun periaatteen on näytettävä alla:

Tällä tavalla ensimmäinen taso 1 on täytettys, Sitten 2s, jota seuraa 2p Ja niin edelleen, riippuen siitä, kuinka monta elektronia atomilla tai ionilla on.
Siten hybridisaatio on molekyylejä vastaava ilmiö, koska kukin atomi voi vaikuttaa vain puhtaisiin atomien kiertoratiin (s, p, d -d, F) ja kahden tai useamman atomien kiertoradan yhdistelmän vuoksi muodostetaan sama määrä hybridi -kiertoratoja, jotka sallivat yhteydet elementtien välillä.
Hybridisaatiotyypit
Atomien kiertoradalla on erilaiset muodot ja alueelliset suuntaukset, mikä kasvaa monimutkaisuudessa, kuten alla on esitetty:

On havaittu, että kiertoradalla on vain yksi tyyppi s (pallomainen muoto), kolmen tyyppiset kiertoradat p (Lobulaarinen muoto, jossa jokainen lohko on suunnattu avaruusakselille), viisi orbitaalin tyyppiä d -d ja seitsemän tyyppistä kiertorata F, missä jokaisella kiertoratatyypillä on täsmälleen sama energia kuin luokansa.
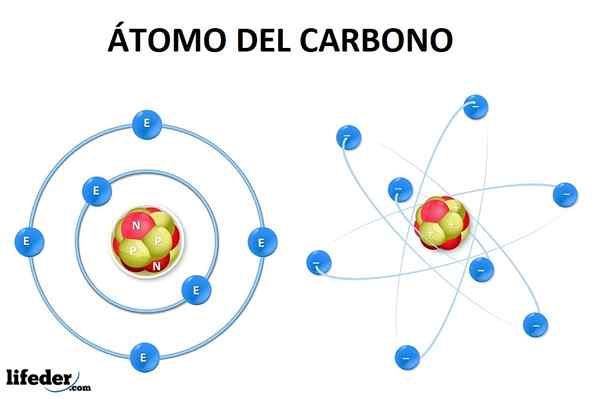
Hiiliatomilla sen perustilassa on kuusi elektronia, joiden kokoonpano on 1s22s22p2. Eli heidän tulisi miehittää taso 1s (kaksi elektronia), 2s (kaksi elektronia) ja osittain 2p (loput kaksi elektronia) Aufbaun periaatteen mukaisesti.
Voi palvella sinua: AlotropiaTämä tarkoittaa, että hiiliatomilla on vain kaksi puuttuvaa elektronia kiertoradalla 2p, Mutta metaanimolekyylin muodostumista tai geometriaa ei ole mahdollista selittää (CH4) tai muu monimutkaisempi.
Joten näiden linkkien muodostamiseksi tarvitaan orbitaalien hybridisaatio s ja p (Hiilen tapauksessa), jotta voidaan tuottaa uusia hybridi -kiertoratoja, jotka jopa selittävät kaksois- ja kolminkertaiset sidokset, joissa elektronit saavat vakaimman kokoonpanon molekyylien muodostumiseksi.
SP3
Hybridisaatio SP3 Se koostuu neljän "hybridi" kiertoradan muodostumisesta Orbitals 2S: stä, 2P: stäx, 2 pja ja 2pz -z Puhdas.
Siten tasolla 2 on elektronien uudelleenjärjestely, jossa on saatavana neljä elektronia neljän sidoksen muodostumiseen ja tilataan rinnakkain, jotta saadaan vähemmän energiaa (suurempi stabiilisuus).
Esimerkki on eteenimolekyyli (C2H4), jonka linkit muodostavat 120 ° kulmat atomien välillä ja tarjoavat tasaisen trigonaalisen geometrian.
Tässä tapauksessa syntyy yksinkertaisia C-H- ja C-C-linkkejä (orbitaalien takia SP2) ja kaksinkertainen C-C-sidos (orbitaalin takia p), Vakaan molekyylin muodostamiseksi.

SP2
SP -hybridisaation kautta2 Kolme ”hybridi” -kiertorataa syntyy Pure 2s -kiertoradalla. Lisäksi saadaan puhdas P -kiertorata, joka osallistuu kaksoissidoksen muodostumiseen (nimeltään Pi: "π").
Esimerkki on eteenimolekyyli (C2H4), jonka linkit muodostavat 120 ° kulmat atomien välillä ja tarjoavat tasaisen trigonaalisen geometrian. Tässä tapauksessa syntyy yksinkertaisia C-H- ja C-C-linkkejä (SP-orbitaalien takia2) ja kaksinkertainen C-C-sidos (orbitaalin P) muodostamiseksi stabiilimpaan molekyyliin.
Voi palvella sinua: Kemialliset reaktiot: Ominaisuudet, osat, tyypit, esimerkit SP
SP
SP -hybridisaation kautta kaksi ”hybridi” -orbitaalia perustetaan Pure 2s Orbital Orbitalista. Tällä tavoin ne muodostavat kaksi puhdasta orbitaalia, jotka osallistuvat kolminkertaisen linkin muodostumiseen.
Tämän tyyppiselle hybridisaatiolle asetyleenimolekyyli (C2H2), jonka linkit muodostavat 180 ° kulmat atomien välillä ja tarjoavat lineaarisen geometrian.
Tätä rakennetta varten on olemassa yksinkertaisia C-H- ja C-C-linkkejä (orbitaalien SP: n takia) ja kolminkertainen C-C-linkki (ts. Kaksi PI-sidosta orbitaalien P) saamiseksi) konfiguraation saamiseksi vähemmän elektronisella torjumisella.

Viitteet
- Kiertoradan hybridisaatio. Haettu jstk.Wikipedia.org
- Kettu, m. -Lla., Ja Whitsell, J. K -k -. (2004). Orgaaninen kemia. Palautettu kirjoista.Google.yhteistyö.mennä
- Carey, f. -Lla., ja Sundberg, R. J -. (2000). Edistynyt orgaaninen kemia: Osa A: Rakenne ja mekanismit. Palautettu kirjoista.Google.yhteistyö.mennä
- Anslyn, E. V., Ja Dougherty, D. -Lla. (2006). Moderni fysikaalinen orgaaninen kemia. Palautettu kirjoista.Google.yhteistyö.mennä
- Mathur, r. B -.; Singh, b. P., Ja panda, s. (2016). Hiilen nanomateriaalit: synteesi, rakenne, ominaisuudet ja sovellukset. Palautettu kirjoista.Google.yhteistyö.mennä
- « Kemialliset huokoisuusominaisuudet, tyypit ja esimerkit
- Morfosyntaktisen tason ominaisuudet ja kirjalliset resurssit (esimerkit) »

