Alifaattiset hiilivetyominaisuudet, nimikkeistö, reaktiot, tyypit

- 714
- 28
- Arthur Terry II
Se Alifaattiset hiilivedyt He ovat kaikkia niitä, joilla ei ole aromaattisuutta, eivät hajuisissa mielessä, vaan kemiallisen stabiilisuuden suhteen. Hiilivetyjen luokittelu tällä tavalla on nykyään liian epäselvä ja epätarkka, koska se ei syrjitä erityyppisiä hiilivetyjä, jotka eivät ole aromaattisia.
Siten meillä on alifaattisia hiilivetyjä ja aromaattisia hiilivetyjä. Jälkimmäiset tunnustavat heidän perusyksikköönsä: Benncénico -rengas. Toisaalta muut voivat omaksua minkä tahansa molekyylirakenteen: lineaarisen, haarautuneen, syklisen, tyydyttymättömän, poltisyklisen; Niin kauan kuin heillä ei ole konjugoituja järjestelmiä, kuten bentseeni.
 Sähtenin nestepolttoaine koostuu alifaattisten hiilivetyjen seoksesta. Lähde: Pixnio.
Sähtenin nestepolttoaine koostuu alifaattisten hiilivetyjen seoksesta. Lähde: Pixnio. Termi 'alifaattinen' syntyi kreikkalaisesta sanasta 'aleiphar', mikä tarkoittaa rasvaa, käytettiin myös öljyihin viittaamiseen. Siksi 1800 -luvulla tämä luokitus osoitettiin öljyisistä uutteista saatuille hiilivedyille; Kun taas aromaattiset hiilivedyt uutettiin puusta ja tuoksuvista hartsista.
Orgaanisen kemian perustana konsolidoidun perustana havaittiin, että oli olemassa kemiallinen ominaisuus, joka erotti hiilivedyt, jopa tärkeämmät kuin niiden luonnolliset lähteet: aromaattisuus (eikä tuoksua).
Tällä tavoin alifaattiset hiilivedyt lakkasivat olevan vain rasvoilta saatuja, kaikki ne, joilla ei ole aromaattisuutta. Tässä perheessä meillä on alkeenit ja alkynit riippumatta siitä, ovatko ne lineaarisia vai syklisiä. Siksi 'alifaattista' pidetään epätarkkoina; Vaikka se on hyödyllistä käsitellä joitain yleisiä näkökohtia.
Esimerkiksi, kun sanotaan 'äärimmäisyydet' tai 'ketjut' alifaattiset, molekyylialueet viitataan mihin aromaattiset renkaat puuttuvat. Kaikista alifaattisista hiilivedyistä yksinkertaisin määritelmän mukaan metaani, Cho4; Kun taas bentseeni on yksinkertaisin aromaattisista hiilivedyistä.
[TOC]
Alifaattisten hiilivetyjen ominaisuudet
Alifaattisten hiilivetyjen ominaisuudet värähtelevät eri asteissa riippuen siitä, mitkä otetaan huomioon. Siellä on matalaa ja korkeaa molekyylimassaa, samoin kuin lineaarisia, haarautuneita, syklisiä tai poltisyklisiä, jopa uskomattomia kolmiulotteisia rakenteita; Kuten Kuuban kanssa, kuution muodossa.
On kuitenkin joitain yleisyyksiä, jotka voidaan mainita. Useimmat alifaattiset hiilivedyt ovat hydrofobisia ja apolaarisia kaasuja tai nesteitä, joilla on jonkin verran apolaarisempia kuin toiset, koska jopa hiiliketjuissa on halogeeni-, happi-, typpi- tai rikiatomeja sisällytetään luetteloon.
Voi palvella sinua: boori: historia, ominaisuudet, rakenne, käyttötarkoituksetNe ovat myös syttyviä yhdisteitä, koska ne ovat alttiita hapettumiselle ilmassa ennen vähimmäislämpölähdettä. Tämä ominaisuus muuttuu vaarallisemmaksi, jos lisäämme sen suurta volatiliteettia johtuen heikoista dispergoivista vuorovaikutuksista, jotka ylläpitävät alifaattisia molekyylejä koheesiona.
Esimerkiksi näemme sen butaanissa, kaasua, joka voidaan nesteyttää suhteellisen helposti ja propaania. Molemmat ovat erittäin haihtuvia ja syttyviä, joten ne ovat aktiivisia komponentteja keittiön kaasu- tai taskujen sytyttimiä.
Tällaisella volatiliteetilla on tietenkin vähentynyt, kun molekyylimassa ja hiilivety aiheuttaa yhä enemmän viskoosisia nesteitä.
Nimikkeistö
Hiilivetyjen nimikkeistö eroaa jopa sen ominaisuuksista. Jos ne ovat alko- tai alkineja, noudatetaan samoja IUPAC: n määräämiä standardeja: Valitse pisin ketju, joka osoittaa pienimmät indikaattorit eniten korvatulle päähän tai heteroatomiin tai reaktiivisemmille ryhmille tai enemmän reaktiivisia ryhmiä.
Tällä tavalla tiedät, missä hiilessä kukin korvike löytyy tai jopa tyydyttymättömyys (kaksinkertainen tai kolminkertainen linkki). Syklisten hiilivetyjen tapauksessa nimeä edeltää aakkosjärjestyksessä luetellut substituentit, joita seuraa sana 'sykli', laskemalla sen integroivat hiilinumerot, jotka integroivat.
Tarkastele esimerkiksi seuraavia kahta sykloheksilaisia:
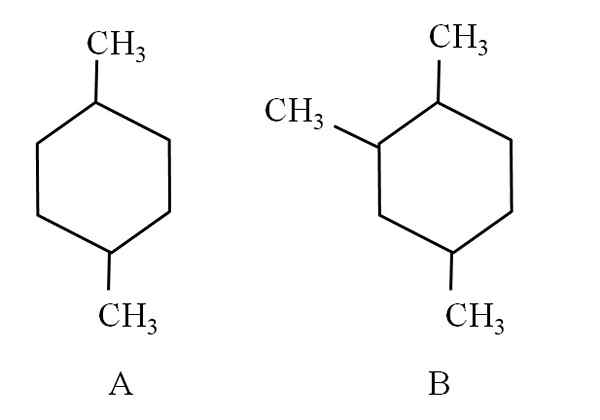 Kaksi sykloheksialaista, jotka luokitellaan alifaattisiksi hiilivediksi. Lähde: Gabriel Bolívar.
Kaksi sykloheksialaista, jotka luokitellaan alifaattisiksi hiilivediksi. Lähde: Gabriel Bolívar. Sykloheksania A kutsutaan 1,4-dimetyylisikloheksaniksi. Jos rengas olisi viisi hiilyä, se olisi 1,4-dimetyylisiklopentano. Samaan aikaan sykloheksania B kutsutaan 1,2,4-trimetyylisykloheksaniksi eikä 1,4,6-sykloheksaniksi, koska se pyrkii käyttämään alhaisimpia indikaattoreita.
Nyt nimikkeistöstä voi tulla erittäin monimutkainen operaboottisille rakenteille hiilivetyille. Heille on olemassa tarkempia sääntöjä, jotka on selitettävä erikseen ja huolellisesti; Kuten tavoitteet, terpeenit, politiikat ja polysykliset yhdisteet.
Reaktiot
Palaminen
Onneksi reaktiot ovat vähemmän vaihtelevia näille hiilivedyille. Yksi niistä mainittiin jo: ne ovat helposti palamisia, tuottaen hiilidioksidia ja vettä muiden oksidien tai kaasujen lisäksi heteroatomien (Cl, N, P, O, O, Eye jne.-A. Kuitenkin CO2 ja h2Tai ovat tärkeimmät palamistuotteet.
Lisäys
Jos heillä on tyydyttymistä, he voivat kärsiä lisäysreaktioista; Eli ne sisällyttävät pienet molekyylit luurankoonsa substituenteina tietyn mekanismin jälkeen. Näistä molekyyleistä meillä on vesi, vety ja halogeenit (F2, Cl2, Br2 ja minä2-A.
Halogeenointi
Toisaalta alifaattiset hiilivedyt ultraviolettisäteilyllä (HV) ja lämpö voivat rikkoa C-H-linkkejä muuttaaksesi niitä C-X-linkillä (C-F, C-C-CL jne.-A. Tämä on halogenointireaktio, jota havaitaan hyvin lyhyen ketjun alkaanissa, kuten metaani tai Pentan.
Voi palvella sinua: Nitriitit: Ominaisuudet, rakenne, nimikkeistö, muodostuminenCraqueo
Toinen reaktio, johon alifaattiset hiilivedyt voivat kärsiä, etenkin pitkäketjut alkaanit, on lämpöhalkeaminen. Se koostuu voimakkaan lämmön tarjonnasta siten, että lämpöenergia rikkoo C-C-sidoksia ja siten pieniä molekyylejä, jotka on enemmän lainattu polttoainemarkkinoilla, suurista molekyyleistä muodostetaan.
Yllä olevat neljä reaktiota ovat tärkeimpiä, jotka voivat kärsiä alifaattisesta hiilivedystä, palamisen on tärkein, koska se ei syrjitä mitään yhdistettä; Kaikki palavat hapen läsnä ollessa, mutta kaikki eivät lisää molekyylejä tai murtautuvat pieniin molekyyleihin.
Kaverit
Alifaattiset hiilivetyryhmät Ryhmä loputtomat yhdisteet, jotka puolestaan luokitellaan tarkempiin, mikä osoittaa niiden tyydyttymättömyyden asteen sekä niiden rakenteen tyypin.
Miten tyydyttymättömät ne ovat, meillä on alkaanit (tyydyttyneet), alkeenit ja alkynit (tyydyttymättömät).
Alkaanille on ominaista, että niissä on yksinkertaiset C-C-linkit, kun taas alkeenissa ja alkeissa havaitsemme vastaavasti linkkejä C = C ja C ja CÖC. Hyvin yleinen tapa visualisoida niitä on ajatella alkaanien hiilirurankoja siksagenina ja taitettuina ketjuina, jotka ovat "neliö" alkeenia ja "suorat linjat" alkineille.
Tämä johtuu siitä, että kaksois- ja kolminkertaisilla sidoksilla on energiaa ja stenric -rajoituksia niiden rotaatioissa "kovettuen" niiden rakenteitaan.
Alkitos ja alkinit voidaan haarautua, syklinen tai poltisyklinen. Siksi sykloalkaania, sykloalquenoja, sykloalkinosia ja yhdisteitä, kuten dekaliini (polkupyörän rakenne), adamantano (samanlainen kuin baseball -lippis), heptaleeni, gonano, otetaan huomioon myös alifaattiset hiilivetyjä.
Alkeenista syntyy muun tyyppisiä hiilivetyjä, kuten tavoitteet (kahdella kaksois sidoksella), polenious (monilla kaksoisvaihtoehtoisilla sidoksilla) ja terpeenejä (isopreenistä johdettuja yhdisteitä, dieeniä).
Sovellukset
Näiden hiilivetyjen käyttö voi jälleen vaihdella riippuen siitä, kumpi otetaan huomioon. Ominaisuuksien ja reaktioiden osissa tehtiin kuitenkin selväksi, että kaikki palaminen ei vain kaasumolekyylien vapauttamiseksi, vaan myös valoa ja lämpöä. Siten ne ovat energiasäiliöitä, jotka ovat hyödyllisiä toimimaan polttoaineina tai lämmönlähteinä.
Siksi niitä käytetään osana bensiinin koostumusta, maakaasua varten, Bunsen -sytyttimissä ja yleensä voidakseen saada aikaan tulipalon.
Voi palvella sinua: Octet -sääntöYksi merkittävimmistä esimerkeistä on asetyleeni, HC≡CH, jonka palaminen mahdollistaa näytteen metalli -ionien herättämisen analyyttisissä testeissä suoritetussa atomien absorptiospektrometriassa. Samoin tuloksena saatua tulipaloa voidaan käyttää hitsauksiin.
Nestemäisiä alifaattisia hiilivetyjä, kuten parafiinia, käytetään usein rasvan uuttamisliuottimina. Lisäksi sen liuotintoimintaa voidaan käyttää pisteiden, emalien, maalauksien tai yksinkertaisesti tietyn orgaanisen yhdisteen liuoksien valmistamiseen.
Suurin molekyylimassa, jo viskoosinen tai kiinteä, on tarkoitettu hartsien, polymeerien tai lääkkeiden kehittämiseen.
Termin "alifaattinen" suhteen sitä käytetään yleensä viittaamaan näihin alueisiin makromolekyylissä, joilla ei ole aromaattisuutta. Esimerkiksi asfaltens kuvataan pinnallisesti aromaattisena ytimenä alifaattisilla ketjuilla.
Esimerkit
Aluksi sanottiin, että metaani on yksinkertaisin alifaattisia hiilivetyjä. Niitä seuraa propaani, Cho3CH2CH3, Butano, ch3CH2CH2CH3, Pentano, ch3CH2CH2CH2CH3, Oktaani, nonano, dekaani ja niin edelleen, joilla on yhä pitkät alkaanit.
Sama pätee eteeniin, Cho2= Ch2, Propeno, ch3Ch = ch2, Buteno, ch3CH2Ch = ch3, Ja muille alkinille. Jos kaksoissidoksia on kaksi, ne ovat Oley ja jos niitä on enemmän kuin kaksi, Polenas. Samoin samassa luurankoissa voi olla kaksinkertainen ja kolminkertainen linkki, lisäämällä rakenteellista monimutkaisuutta.
Sykloalaanien joukossa voimme mainita syklopropanin, syklobutaanin, syklopentanon, sykloheksanin, sykloheptanon, syklooktaanin sekä sykloheksenin ja sykloheksiinin. Kaikista näistä hiilivedyistä saadaan haaroittuja johdannaisia, jotka kertovat edelleen käytettävissä olevia esimerkkejä (kuten 1,4-dimetyylisikloheksano).
Edustavimmista terpeeneistä meillä on limoneeni, mentol, pineeni, A -vitamiini, escualeno jne. Polyeteeni on tyydyttynyt polymeeri, jolla on yksiköt -CH2-CH2-, Joten se on myös esimerkki näistä hiilivedyistä. Muita esimerkkejä on jo mainittu edellisissä osissa.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10. painos.-A. Wiley Plus.
- Helmestine, Anne Marie, PH.D -d. (22. elokuuta 2019). Alifaattinen hiilivetymääritys. Toipunut: Admingco.com
- Wikipedia. (2019). Alifaattinen yhdiste. Haettu: vuonna.Wikipedia.org
- Kemian librettexts. (20. elokuuta 2019). Alifaattiset hiilivedyt. Palautettu: Chem.Librettexts.org
- Elizabeth Wyman. (2019). Alifaattiset hiilivedyt: Määritelmä ja ominaisuudet. Opiskelu. Toipunut: Opiskelu.com
- « Sosiaalinen ulottuvuus on inhimillinen, koulutus, tietoa, oikeutta, terveyttä
- 100 utelias eläintietoa »

