Hydrolasaasirakenne, toiminnot, esimerkit

- 3110
- 27
- Sheldon Kuhn
Se Hydrolaasi Ne ovat entsyymejä, jotka ovat vastuussa erityyppisten kemiallisten linkkien hydrolysoinnista monissa eri yhdisteissä. Tärkeimpien linkkien joukossa, jotka hydrolysa.
Hydrolaasiryhmässä yli 200 erilaista entsyymiä on luokiteltu, ryhmitelty vähintään 13 yksittäistä sarjaa; Sen luokittelu perustuu olennaisesti kemiallisen yhdisteen tyyppiin, joka toimii substraattina.
 Graafinen mallintaminen hydrolaasin rakenteen bioinformatiikan työkaluilla (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen verkkotunnus] Wikimedia Commonsin kautta) Wikimedia Commonsin kautta)
Graafinen mallintaminen hydrolaasin rakenteen bioinformatiikan työkaluilla (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen verkkotunnus] Wikimedia Commonsin kautta) Wikimedia Commonsin kautta) Hydrolaasit ovat välttämättömiä elintarvikkeiden sulamiseen eläinten suolistossa, koska ne ovat vastuussa suuren osan hajottamisesta, jotka muodostavat niiden ruoan hiilihapolliset rakenteet.
Nämä entsyymit toimivat vesipitoisissa väliaineissa, koska ne tarvitsevat niiden ympärillä olevia vesimolekyylejä yhdisteiden lisäämiseksi, kun molekyylit on jaettu. Yksinkertaisesti sanoin hydrolaasit suorittavat hydrolyyttisen katalyysin yhdisteistä, joihin ne toimivat.
Esimerkiksi, kun hydrolaasi rikkoo C-C-kovalenttisen sidoksen, tulos on yleensä C-O-ryhmä ja C-H-ryhmä.
[TOC]
Rakenne
Kuten monet entsyymit, myös hydrolaasit ovat järjestäytyneitä globaaleja proteiineja kompleksirakenteissa, jotka on järjestetty molekyylin sisäisten vuorovaikutusten kautta.
Hydrolaasit, kuten kaikki entsyymit, sitoutuvat yhteen tai useampaan substraattimolekyyleihin sen rakenteen alueella, joka tunnetaan "aktiivisena kohta". Tämä paikka on tasku tai rako, jota ympäröivät monet aminohappotähteet, jotka helpottavat substraatin pitoa tai liiton.
Jokainen hydrolaasityyppi on spesifinen tietylle substraatille, joka määritetään sen tertiäärisellä rakenteella ja muodostumalla aminohappoja, jotka tekevät niiden aktiivisesta paikasta. Emil Fischer herätti tämän spesifisyyden didaktisesti eräänlaisena "avaimena ja lukkoina".
Voi palvella sinua: Polymeraasi: Ominaisuudet, rakenne ja toiminnotTällä hetkellä tiedetään, että substraatti indusoi yleensä muutoksia tai vääristymiä entsyymien muodostumisessa ja että entsyymit puolestaan vääristävät substraatin rakennetta varmistaakseen, että tämä ”pitsi” sen aktiivisessa paikassa.
Funktiot
Kaikilla hydrolaaseilla on päätehtävä kemiallisten sidosten katkaisemiseksi kahden yhdisteen välillä tai saman molekyylin rakenteen sisällä.
On hydrolaaseja melkein minkä tahansa tyyppisen linkin katkaisemiseksi: jotkut hajottavat hiilihydraattien, muiden peptidisidosten väliset esterisidokset proteiinin aminohappojen, toiset karboksyylisidoksista jne.
Kemiallisen sidosprosessin tarkoitus, jota katalysoivat hydrolaasientsyymi, vaihtelee huomattavasti. Esimerkiksi Smozyme vastaa kemiallisten sidosten hydrolyysistä organismin suojaustarkoituksiin, jotka syntetisoivat sen.
Tämä entsyymi heikentää yhteyksiä, jotka pitävät yhdessä bakteerien soluseinämän yhdisteiden kanssa, tavoitteena on suojata ihmiskehoa bakteerien lisääntymiseltä ja mahdolliselta infektiolta.
Nukleat ovat ”fosfataasi” entsyymejä, joilla on kyky hajottaa nukleiinihappoja, jotka voivat myös edustaa solupuolustusmekanismia DNA- tai RNA -viruksia vastaan.
Muut hydrolaasit, kuten "proteaasien" tyypin, hajottavat ruoansulatuskanavan proteiinien peptidisidokset, jotta aminohappoja voidaan ottaa huomioon maha -suolikanavan epiteelissä.
Jopa hydrolaasit ovat mukana erilaisissa energiantuotantotapahtumissa solujen aineenvaihdunnassa, koska fosfataasit katalysoivat fosfaattimolekyylien vapautumista korkean energian substraateista, kuten pyruvaatista, glykolyysissä.
Se voi palvella sinua: soijapaputEsimerkkejä hydrolasaasista
Tutkijoiden tunnistamien hydrolaasien monimuotoisuuden joukossa joitain on tutkittu enemmän kuin toiset, koska ne ovat mukana monissa olennaisissa prosesseissa soluelämän kannalta.
Näiden joukossa ovat sileys, proteaasi -seriini, endonukle- ja glukosidaasi tai glykosyraeous -fosfataasit.
Sileys
Tämän tyyppiset entsyymit. Tämä lopulta aiheuttaa bakteerien täydellisen hajotuksen.
Smotsyymit puolustavat bakteeri -infektioiden eläinten runkoa ja ovat runsaasti kehon erityksissä kudoksissa, jotka ovat kosketuksissa ympäristöön, kuten esimerkiksi kyyneleet, sylki ja limatiteetti.
Sileä kana -muna oli ensimmäinen proteiinirakenne, joka kiteytyi x -rakojen läpi. Tämän kiteytyksen teki David Phillips vuonna 1965 Lontoon Real Institute.
Tämän entsyymin aktiivinen kohta koostuu asparagiini-alaniini-mekaniinista-peparagiini-glysiini-glysiini-peragin-plain-metioniinipeptidistä (nam-nag-nam).
Proteaasi -seriinit
Tämän ryhmän entsyymit ovat vastuussa peptidisidosten hydrolysoinnista peptideissä ja proteiineissa. Yleisimmin tutkittuja ovat trpsiini ja chimotripsin; Proteaaseita on kuitenkin monia erityyppisiä, jotka vaihtelevat substraatin ja sen katalyysimekanismin spesifisyyden suhteen.
"Proteaaseille" on ominaista seriinityyppisen nukleofiilisen aminohappo. Proteasas Serin pystyy myös murtamaan monenlaisia esterilinkkejä.
Voi palvella sinua: mikä on elävien olentojen kemiallinen koostumus?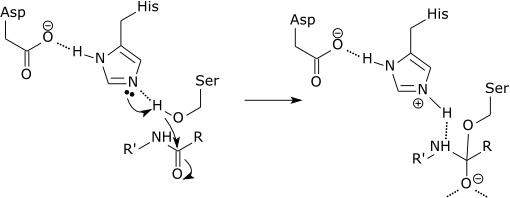 Graafinen kaavio siitä, että proteaasi on hajottaen peptidilinkin histidiiniaminohapossa (lähde: zephyris englannin kielellä Wikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/)] Wikimedia Commonsin kautta)
Graafinen kaavio siitä, että proteaasi on hajottaen peptidilinkin histidiiniaminohapossa (lähde: zephyris englannin kielellä Wikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/)] Wikimedia Commonsin kautta) Nämä entsyymit leikkaavat peptidejä ja proteiineja epäspesifisellä tavalla. Kaikkia leikattavia peptidejä ja proteiineja on kuitenkin sitoa peptidilinkin N-terminaalinen pää entsyymin aktiiviseen kohtaan.
Jokainen lyhyt proteaasi on tarkasti AMIDA-sidos, joka muodostuu aminohapon C-terminaalisen pään karboksyylipäässä ja aminiinihappo-amiinissa, joka on kohti peptidin N-terminaalista päätä.
Nukleaasifosfataasit
Nämä entsyymiluettelo. Näitä entsyymejä on monia erityyppisiä, koska ne ovat spesifisiä nukleiinihapon ja leikkauskohdan tyypille.
 Fosfodiéster-sidoksen endonukleaasien hydrolysaation graafinen kaavio (lähde: J3D3 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Fosfodiéster-sidoksen endonukleaasien hydrolysaation graafinen kaavio (lähde: J3D3 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Endonukleaasit ovat välttämättömiä bioteknologian alalla, koska niiden avulla tutkijat voivat modifioida organismien genomeja leikkaamalla ja korvaamalla fragmentit melkein minkä tahansa solun geneettisistä tiedoista.
Endonukleaasit tekevät typpipohjojen leikkaamisesta kolmessa vaiheessa. Ensimmäinen on nukleofiilisen aminohapon kautta, sitten välittäjä rakenne muodostuu negatiivisella kuormalla, joka houkuttelee fosfaattiryhmää ja lopulta katkaisee yhteyden kahden emäksen välillä.
Viitteet
- Davies, G., & Henrissat, b. (tuhatyhdeksänsataayhdeksänkymmentäviisi). Glykosyylihydrolien rakenteet ja mekanismit. Rakenne, 3 (9), 853-859.
- Lehninger, a. Lens., Nelson, D. Lens., Cox, m. M., & Cox, M. M. (2005). Lehninger -biokemian periaatteet. Macmillan.
- Mathews, a. P. (1936). Biokemian periaatteet. W -. Puu.
- Murray, r. K -k -., Granner, D. K -k -., Mayes, P., & Rodwell, V. (2009). Harperin kuvitettu biokemia. 28 (p. 588). New York: McGraw-Hill.
- Ollis, d. Lens., Cheeah, e., Cygler, M., Dijkstra, b., Folow, f., S. S. M.,… & Sussman, J. Lens. (1992). Α/β -hydrolaasitieto. Tekninen proteiini, suunnittelu ja valinta, 5 (3), 197-211.

