Litiumhydridirakenne, ominaisuudet, hankkiminen, käyttö
- 5086
- 1227
- Arthur Terry II
Hän Litiumhydridi Se on kiteinen epäorgaaninen kiinteä aine, jonka kemiallinen kaava on LiH. Se on kevyin epäorgaaninen suola, sen molekyylipaino on vain 8 g/mol. Sen muodostuu litium -ionin liitosta+ ja hydridi H -ioni-. Molemmat yhdistyvät ioninen joukkovelkakirjalaina.
LIH: lla on korkea sulamispiste. Se reagoi helposti veden kanssa ja reaktiossa tapahtuu vetykaasua. Se voidaan saada reaktiolla sulan litiummetallin ja vetykaasun välillä. Sitä käytetään laajasti kemiallisissa reaktioissa muiden hydrorien saamiseksi.
 Litiumhydridi, liH. Ei konetta luettavissa olevaa kirjailijaa. Jtiago oletettu (perustuu tekijänoikeusvaatimuksiin). [Julkinen verkkotunnus]. Lähde: Wikimedia Commons.
Litiumhydridi, liH. Ei konetta luettavissa olevaa kirjailijaa. Jtiago oletettu (perustuu tekijänoikeusvaatimuksiin). [Julkinen verkkotunnus]. Lähde: Wikimedia Commons. LIH: ta on käytetty suojaamiseen vaaralliselta säteilystä, kuten ydinreaktoreista, nämä ovat alfa, beeta, gammasäteily, protonit, x -säteilyt ja neutronit.
Sitä on ehdotettu myös ydinlämpöpotkun liikkuvien avaruusrakettien materiaalien suojaamiseksi. Tutkimuksia käytetään jopa ihmisen suojeluna kosmista säteilyä vastaan tulevien matkojen aikana planeetalle Marsille.
[TOC]
Rakenne
Litiumhydridissä vedyssä on negatiivinen kuorma H-, No, elektroni on varastanut metalliin, joka on ionin muodossa+.
Elektroninen kationin konfiguraatio Li+ Se on: [hän] 1s2 mikä on erittäin vakaa. Ja hydridi H: n elektroninen rakenne- Se on: 1s2, mikä on myös erittäin vakaa.
Kation ja anioni sitovat sähköstaattisia voimia.
Litiumhydridillä on sama rakenne kuin natriumkloridilla, ts. Kuubinen kiteinen rakenne.
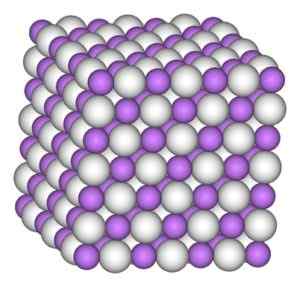 Litiumhydridin kuutiomettinen kiteinen rakenne. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
Litiumhydridin kuutiomettinen kiteinen rakenne. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Nimikkeistö
- Litiumhydridi
- Liv
Ominaisuudet
Fyysinen tila
Valkoinen tai väritön kiteinen kiinteä. Kaupallinen LIH voi olla harmahtavaa sinistä, koska litiummetallia on pieniä määriä.
Molekyylipaino
8 g/mol
Sulamispiste
688 ºC
Kiehumispiste
Se hajoaa 850 ºC: n nopeudella.
Itsensuuntainen lämpötila
200 ºC
Tiheys
0,78 g/cm3
Liukoisuus
Reagoi veden kanssa. Se on liukenematon eettereissä ja hiilivedissä.
Muut ominaisuudet
Litiumhydridi on paljon stabiilempi kuin muiden emäksisten metallien hydros ja voi olla sulaa ilman hajoamista.
Voi palvella sinua: kuiva akkuHappi ei vaikuta siihen, jos se lämmitetään punaisilla lämpötiloissa. Kloori CL ei myöskään vaikuta siihen2 ja HCL -suolahappo.
LIH -kosketus lämmön ja kosteuden kanssa aiheuttaa eksotermisen reaktion (tuottaa lämpöä) ja vedyn kehitystä H2 ja litiumhydroksidi lioh.
Se voi muodostaa hienon pölyn, jota voidaan hyödyntää kosketuksessa liekkien, lämmön tai hapettavien materiaalien kanssa. Sinun ei pidä koskettaa typpioksidia tai nestemäistä happea, koska se voi hyödyntää tai käynnistää.
Se tummenee altistumalla valolle.
Saada
Litiumhydridi on saatu laboratoriossa reaktiolla sulan litiummetallin ja vetykaasun välillä lämpötilassa 973 K (700 ° C).
2 li + h2 → 2 LIH
Hyviä tuloksia saadaan, kun sulan litiumin paljaat pinnat lisääntyvät ja kun LIH: n sedimentaatioaika lyhenee. Se on eksoterminen reaktio.
Käytän suojakilveenä vaarallista säteilyä vastaan
LIH esittelee sarjan ominaisuuksia, jotka tekevät siitä houkuttelevan käytettäväksi ihmisen suojeluna ydinreaktoreissa ja avaruusjärjestelmissä. Tässä on joitain näistä ominaisuuksista:
- Siinä on korkea vetypitoisuus (12,68 % painon mukaan) ja suuri määrä vetyatomeja tilavuusyksikköä kohti (5,85 x 1022 H/cm -atomit3-A.
- Sen korkea sulamispiste mahdollistaa sen käytön korkean lämpötilan ympäristöissä ilman perustamista.
- Sillä on alhainen dissosiaatiopaine (~ 20 torr sulamispisteessä), mikä mahdollistaa materiaalin valun ja jäädyttävän hajottamatta alhaisella vetypaineessa.
- Sillä on pieni tiheys, mikä tekee siitä houkuttelevan käyttää avaruusjärjestelmissä.
- Heidän haittansa ovat kuitenkin niiden alhainen lämmönjohtavuus ja huonot mekaaniset ominaisuudet. Mutta tämä ei ole vähentänyt sen sovellettavuutta.
- LIH -palat, jotka toimivat kilpeinä. Vaikka tämä viimeinen muoto on edullinen.
- Huoneen lämpötilassa osat on suojattu vedeltä ja vesihöyryltä.
- Ydinreaktoreissa
Ydinreaktoreissa säteilytyyppejä on kahta tyyppiä:
Voi palvella sinua: hapot ja emäkset jokapäiväisessä elämässä: reaktiot, käytöt, esimerkitSuora ionisoiva säteily
Ne ovat erittäin energiahiukkasia, joilla on sähkövaraus, kuten alfa (α) ja beeta (β) ja protonien hiukkaset. Tämäntyyppiset säteilyt ovat vuorovaikutuksessa erittäin voimakkaasti kilpien materiaalien kanssa aiheuttaen ionisaation vuorovaikutuksessa materiaalien materiaalien elektronien kanssa, joiden kautta ne kulkevat.
Epäsuorasti ionisoiva säteily
Ne ovat neutroneja, gammasäteitä (γ) ja x -säteitä, jotka ovat tunkeutuvia ja vaativat massasuojaa, koska niihin liittyy ladatettujen sekundaarihiukkasten päästö, jotka aiheuttavat ionisaation.
 Symboli varoittaa vaarallisesta säteilystä. IAEA & ISO [julkinen alue]. Lähde: Wikimedia Commons.
Symboli varoittaa vaarallisesta säteilystä. IAEA & ISO [julkinen alue]. Lähde: Wikimedia Commons. Joidenkin lähteiden mukaan LIH on tehokas suojelemaan materiaaleja ja ihmisiä tämän tyyppisiltä säteilyssä.
- Ydin-
LIH on äskettäin valittu potentiaaliseksi moderaattoriksi ja suojaavaksi materiaaliksi ytimen säteilyä vastaan avaruusaluksen ydinlämpökäyttöjärjestelmissä erittäin pitkille matkoille.
 Space -ajoneuvon taiteellinen esitys ydinvoimalaitoksella Marsin kiertoradalla. NASA/SAIC/PAT Rawlings [julkinen alue]. Lähde: Wikimedia Commons.
Space -ajoneuvon taiteellinen esitys ydinvoimalaitoksella Marsin kiertoradalla. NASA/SAIC/PAT Rawlings [julkinen alue]. Lähde: Wikimedia Commons. Sen alhainen tiheys ja korkea vetypito.
- Suojaa kosmista säteilyä vastaan
Altistuminen avaruussäteilylle on tärkein ihmisten terveyden riski tulevissa planeettojenvälisissä etsintäoperaatioissa.
Syvässä tilassa astronautit altistuvat galaktisten kosmisten säteiden (korkean energian ionien) ja aurinkopartikkelien poistotapahtumien (protonien) kokonaiselle spektrille.
Säteilyaltistuksen vaara pahenee lähetysten keston vuoksi. Lisäksi niiden paikkojen suojaaminen, joihin tutkijoita on otettava huomioon.
 Tulevaisuuden elinympäristön simulointi Planet Marsissa. NASA [julkinen alue]. Lähde: Wikimedia Commons.
Tulevaisuuden elinympäristön simulointi Planet Marsissa. NASA [julkinen alue]. Lähde: Wikimedia Commons. Tässä ideojärjestyksessä vuonna 2018 tehdyssä tutkimuksessa todettiin, että todistettujen materiaalien joukossa LIH tarjoaa korkeimman säteilyn vähentämisen grammaa kohti cm: tä kohti2, Siten yksi parhaimmista ehdokkaista, jota käytetään suojassa kosmista säteilyä vastaan. Nämä tutkimukset on kuitenkin syvennettävä.
Käytän varastointiaineena ja turvallista vedyn kuljetusta
Energian hankkiminen H: sta2 Se on jotain, jota on tutkittu useita kymmeniä vuosia, ja se on jo löytänyt sovelluksen fossiilisten polttoaineiden korvaamiseksi kuljetusajoneuvoissa.
Voi palvella sinua: Kemiallinen tasapaino: Selitys, tekijät, tyypit, esimerkitH2 Sitä voidaan käyttää polttokennoissa ja edistää CO -tuotannon vähentämistä2 ja eix, siten välttäen kasvihuonevaikutusta ja pilaantumista. H: n varastointia ja kuljettamista koskevaa tehokasta järjestelmää ei kuitenkaan ole vielä löydetty2 Varmasti kevyellä, kompaktilla tai pienellä painolla, joka ajaa sitä nopeasti ja vapauttaa H: n2 yhtä nopeasti.
LIH -litiumhydridi on peräisin alkalista hydrorista, jolla on suurin H: n säilytyskapasiteetti2 (12,7 % painon mukaan). Vapauta H2 hydrolyysillä seuraavan reaktion mukaan:
LIH + H2O → lioh + h2
LIH toimittaa 0,254 kg vetyä jokaiselle kg LIH: lle. Lisäksi sillä on korkea säilytyskapasiteetti tilavuusyksikköä kohti, mikä tarkoittaa, että se on kevyt ja on kompakti väliaine H -säilytystilaan2.
 Moottoripyörä, jonka polttoainetta varastoidaan metallisen hydridin muodossa, kuten LIH. TAI.S. DOE -energiatehokas ja uusiutuva energia (USA) [julkinen alue]. Lähde: Wikimedia Commons.
Moottoripyörä, jonka polttoainetta varastoidaan metallisen hydridin muodossa, kuten LIH. TAI.S. DOE -energiatehokas ja uusiutuva energia (USA) [julkinen alue]. Lähde: Wikimedia Commons. Lisäksi LIH muodostuu helpommin kuin muut alkalisen metallin hydrorit ja on kemiallisesti stabiili ympäristölämpötiloissa ja paineissa. LIH voidaan kuljettaa valmistajalta tai toimittajalta käyttäjälle. Sitten syntyy hydrolyysi LIH: sta2 Ja tätä käytetään turvallisesti.
Lioh -litiumhydroksidi voidaan palauttaa toimittajalle, joka regeneroi litiumia elektrolyysillä ja tuottaa sitten uudelleen LiH.
LIH: ta on myös tutkittu onnistuneesti käytettäväksi yhdessä lihavoidun hydrasiinin kanssa samaan tarkoitukseen.
Käyttö kemiallisissa reaktioissa
LIH sallii monimutkaisen hydrorien synteesin.
Se palvelee esimerkiksi litium -trietyyliborohydridin valmistamiseksi, joka on voimakas nukleofiili orgaanisissa haluros -siirtymäreaktioissa.
Viitteet
- Sato, ja. Ja Takeda tai. (2013). Vedyn varastointi- ja kuljetusjärjestelmä litiumhydridin kautta sulaa suolatekniikkaa käyttämällä. Sulan suolan kemiassa. Luku 22, sivut 451-470. ScienEdirect.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Litiumhydridi. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus.
- Wang, l. et al. (2019). Tutkimus lichium-hydridin vaikutuksesta ytimen reaktiivisuuteen. Annals of ydinenergia 128 (2019) 24-32. ScienEdirect.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Giraudo, m. et al. (2018). Kiihdytinpohjaiset testit eri materiaalien ja moniyerien suojaamisesta, joissa käytetään korkeaa kevyitä ja raskaita ioneja. Säteilytutkimus 190; 526-537 (2018). NCBI toipunut.Nlm.NIH.Hallitus.
- Welch, f.H. (1974). Litium hydridi: avaruuskauden suojausmateriaali. Ydintekniikka ja suunnittelu 26, 3, helmikuu 1974, sivut 444-460. ScienEdirect.com.
- Simnad, m.T.(2001). Ydinreaktorit: suojausmateriaalit. Materiaalien tietosanakirjassa: Tiede ja tekniikka (toinen painos). Sivut 6377-6384. ScienEdirect.com.
- Hügy, t. et al. (2009). Hydratsiiniboraani: lupaava vedyn varastointimateriaali. J -. OLEN. Kemia. Soc. 2009, 131, 7444-7446. Pubista toipunut.ACS.org.
- « Amenadiel tarkoittaa, läsnäolo Raamatussa ja Luciferissa
- Maya Medicine -historia, Jumala, kasvit, sairaudet »

