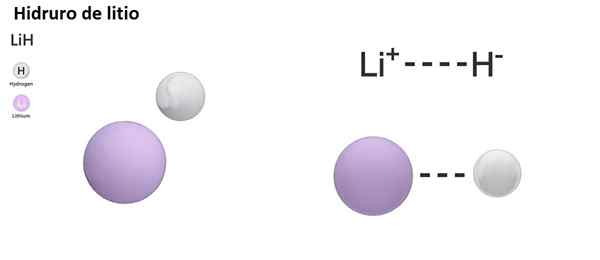Hydrorit
- 3726
- 729
- Sheldon Kuhn
Mitä ovat hydruros?
Hydrosit ovat kemiallisia yhdisteitä, jotka johtuvat vedyn reaktiosta metallielementtien kanssa (natrium, kalium, kalsium jne.) eikä metallit (kloori, fluori, happi, typpi, hiili jne.-A. Vety reagoi melkein kaikkien kemiallisten elementtien kanssa, joten hydrorit ovat hyvin monimuotoisia aineita.
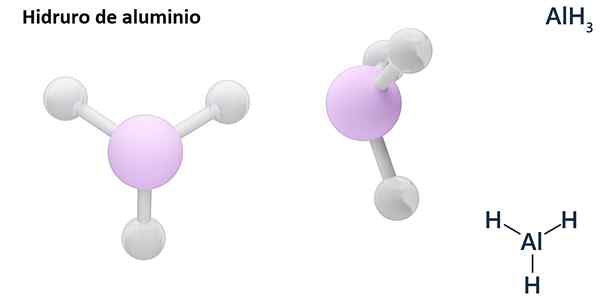
Sen yleiset kaavat voivat olla MH -tyyppin, Missä m on metalli ja n Sen valencia (+1, +2, +3), kuten alumiinihydridi, ALH3; tai EH -tyyppin tai hnJa missä E on ei -metallinen elementti ja n Sen Valencia, kuten NH3 tai h2S.
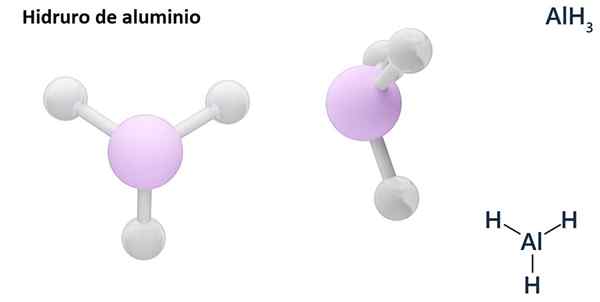
Hydrosit ovat yleensä binaarisia yhdisteitä, ts. Ne johtuvat vedyn yhdistelmästä toisen kemiallisen elementin kanssa. Vety voi kuitenkin myös luoda yhdistelmiä useiden kemiallisten elementtien kanssa monimutkaisempien hydrorien muodostamiseksi. Kaikki selitetyt hydrorit ovat binaarisia, kuten Alh3 ja nah.
Kemiallisen sidoksen luonteen mukaan hydroreita on kolme tyyppiä: ioninen, molekyyli ja metallinen. Ionisille tai suolaliuoksihydroreille on ominaista ionisen sidoksen läsnäolo. Tämä linkki koostuu emäksisen metallin positiivisen kuorman välisestä sähköisestä vetovoimasta (Na+) tai emäksinen-bundle (mg2+) ja hydridianionin negatiivinen kuorma (H--A.
Toisaalta molekyylihydridit on tunnusomaista kovalenttisen sidoksen muodostuminen vedyn ja ei -metallisen elementin välillä. Hydroja muodostavien ei -metallisten elementtien joukossa ovat: kloori, bromi, fluori, jodi, happi ja typpi.
Ja metallihydrorit johtuvat vedyn yhdistelmästä joidenkin siirtymämetallien kanssa. Tämäntyyppisillä hydrideillä, toisin kuin aiemmissa, on monimutkaisia rakenteita, eikä niitä selitetä tässä.
Hydros -ominaisuudet
Hydrurnien ominaisuudet vaihtelevat hydridin tyypistä: ioniset, molekyyliset tai metalliset, joten niiden ominaisuudet on osoitettava erikseen.
Ioni- tai suolaliuoksen hydrorit
Ne ovat kiteisiä valkoisia kiinteitä aineita, mutta epäpuhtauksien esiintymisen vuoksi he saavat harmahtavan värin. Nämä hydridit eivät liukene yleisissä liuottimissa, kuten vesi, alkoholi jne. Heillä on myös korkea kiehumis- ja fuusiopisteet.
Heillä on korkea ja sulan valtion tiheys voi suorittaa sähköä.
Ionisia hydurneita pidetään emäksisinä tai emäksisinä, koska liuennettua vesimuodosta hydroksideja ja vapauttavat molekyylisen vety:
NAH +H2O → h2 + Naoh
Ionisen hydridin reaktio veden kanssa on erittäin voimakasta ja vaarallista: se tuottaa vetyä kaasumuodossa, mikä on palava ja syttyvä materiaali.
Ionic Hydurns voi myös reagoida metallihalogenidien kanssa, jotka on muodostettu metallilla ja ei -metallilla, joka tunnetaan nimellä halogeeni (MX, X = F, CL, BR, I):
Voi palvella sinua: Dimetylanyliini: rakenne, ominaisuudet, synteesi, käyttää4 LIH +ALCL3 → Lialh4 + 3 LICL
LIH (litiumhydridi) on binaarinen yhdiste; kun taas lialh4 (Litium- ja alumiinihydridi) on ternaarinen yhdiste, toisin sanoen se koostuu kolmesta kemiallisesta elementistä.
Molekyyli- tai kovalenttinen hydros
Ne ovat nestemäisessä tai kaasumaisessa tilassa toisin kuin ioniset hydrorit, jotka ovat kiinteitä. Heillä on alhaiset kiehumis- ja fuusiopisteet, jotka tarkkailevat, että nostamalla hydridin molekyylipainoa kiehumispiste kasvaa; lukuun ottamatta ammoniakkia (NH3), Vesi (h2O) ja fluoridihydridi (HF).
Kovalenttiset hydridit ovat huonoja sähköjohtimia, ja monet niiden ominaisuuksista johtuvat vety sillojen muodostumisesta. Kovalenttisia hydridejä pidetään happona, koska veteen liuennut voi aiheuttaa hapoja, esimerkiksi suolahappoa.
Metallihydrorit
Ne ovat kiinteässä tilassa, esittäen metallien tumman sävyn. Ne ovat hyviä sähköjohtimia ja niillä on kiiltäviä pintoja. Metallisista hydridistä, jotka ovat stabiileja ilmassa, tulee reagensseja, kun ne lämmittävät, esimerkiksi uraanihydridi (UH3) Esitä tämä ominaisuus.
Nimikkeistö
Tapa nimetä Hydrors on yksinkertainen, eikä se vaihtele liikaa missään nimikkeessä. Jos metallisella metallilla tai elementillä on useampi kuin yksi valenssi, se on määritelty suluissa ja roomalaisella lukumäärällä varastossa olevan nimikkeistön mukaan.
Esimerkiksi feh3 kutsutaan rautahydridiksi (III) ja COH2 Kobolttivesi (II). Nämä samat hydridit voidaan nimittää myös käyttämällä systemaattista nimikkeistöä, joka käyttää kreikkalaisia numeroita (DI, Tri, Tetra jne.-A. Siten feh3 kutsutaan rautatrihydridiksi ja cohiksi2 koboltti dihydruro.
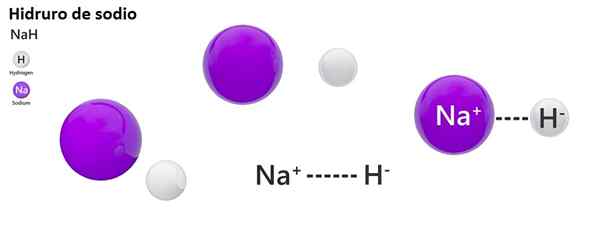
Klassista nimikkeistöä ei käytetä laajalti hydroihin. Esimerkiksi NAH: ta tunnetaan enemmän natriumhydridinä, eikä natriumhydridiä.
 Natriumhydridi
Natriumhydridi Kuinka hydroset muodostetaan?
Ioni- tai suolaliuoksen hydrorit
Ne muodostuvat vedyn reaktiolla metallien ryhmään kuuluvan metallin tai alkalisen terrero-metallien ryhmään.
Näiden metallien kanssa koulutetuissa hydroreissa vetyä löytyy H -muodossa-, tunnetaan nimellä Hydride Anion.
Alkalimetallit (litium, natrium, kalium, rubidium ja cesium) reagoivat vedyn kanssa niiden vastaavien hydurnien muodostamiseksi:
2 m (l)+h2(g) → 2mH (s)
Voi palvella sinua: YksikköoperaatiotMetalli m reagoiessaan on nestemäisessä tilassa ja vety kaasumaisessa tilassa, joten reaktio vaatii korkeita lämpötiloja ja korkeita paineita. Mieti seuraavaa esimerkkiä:
2 li (l) +h2 (g) → 2 liH (s)
Vetyjen reaktio alkalisen kolmannen metallien kanssa (beryllium, magnesium, kalsium, strontium ja barium) hydridien muodostumiselle on samanlainen kuin alkalisen metallien havaittu.
Magnesium ja beryllium muodostavat hydridejä, mutta niiden sidokset vedulla ovat kovalenttisia; Eli ei -ioninen, toisin kuin muut alkaliset metallit:
Ca (l) +h2 (g) → CAH2 (S)
Molekyylihydrorit
Vety voi reagoida ei -metallien kanssa, jotka vastaavat jaksollisen taulukon ryhmiä 14, 15, 16 ja 17, molekyylihydrorien muodostamiseksi. Harkitse esimerkiksi fluoridihydridin muodostumista yhdistelmällä tai suoralla vedyn seoksella fluorin kanssa:
H2 (g) +f2 (g) → 2 HF (g)
HF tunnetaan enemmän vetyfluoridina, mutta sitä kutsutaan myös fluoridihydridiksi.
Lisäksi vety voi reagoida happea (jaksollisen taulukon ryhmä 16) kanssa saman kaavion jälkeen:
2 h2 (g) +tai2 (g) → 2 h2O (g)
Reaktio vaatii lämmönsyöttöä vetyoksidin (vesi) tai happihydridin tuottamiseksi.
Myös vety voi reagoida typen kanssa, joka kuuluu jaksollisen taulukon ryhmään 15 typpihydridin muodostamiseksi, tunnetaan paremmin ammoniakkina (NH3-A.
N2 (g) +3 h2 (g) → 2 NH3 (g)
Reaktio vaatii lämmön syöttöä, korkeaa painetta ja katalyyttien läsnäoloa (ne kiihdyttävät kemiallisia reaktioita).
Metallihydrorit
Ne muodostuvat siirtymämetallien reaktiolla (ryhmät 3, 4, 5, 6, 10, 11 ja 12 jaksollisesta taulukosta) vetyllä. Ryhmien 7, 8 ja 9 siirtymämetallit eivät kuitenkaan muodosta yhdisteitä vedyn kanssa, ilmiö, joka tunnetaan nimellä hydridi- tai rako -hydridi.
Siirtymämetallien hydrorien ainutlaatuinen ominaisuus on, että niillä ei aina ole kiinteää osuutta vetyatomien lukumäärän ja hydridissä olevien atomien lukumäärän välillä. Toisin sanoen niiden kaavat ja rakenteet eivät ole helppoja edustaa.
Käyttää/sovelluksia hydrosten
 Hydrosit ovat hyvin läsnä yhdessä monista paristoista: kuten NIMH. Lähde: Multicherry, CC BY-SA 4.0, Wikimedia Commons
Hydrosit ovat hyvin läsnä yhdessä monista paristoista: kuten NIMH. Lähde: Multicherry, CC BY-SA 4.0, Wikimedia Commons Hydroja on läsnä nikkelimetallisissa hydridiakuissa (NIMH), jota käytetään yhdessä harvinaisten maametallien, koboltin tai mangaanin kanssa. Vetyihin liittyvien solujen ohjaamissa sähköautoissa on tutkittu useita metallihydroreita.
Voi palvella sinua: Redox -tasapainomenetelmä: vaiheet, esimerkit, harjoituksetVähentävät edustajat
Litiumhydridi ja natriumboori (Nabh4) Niitä käytetään kemiallisina reaktioina orgaanisissa synteesireaktioissa.
Vedyn varastointi ja muut siihen liittyvät käytöt
Moottoriajoneuvoissa on vedyn käytön lentäjiä, mutta räjähtävyytensä vuoksi sen käyttö on rajoitettu polttoaineena. Hydrosten käyttöä on ehdotettu vedyn varastoinnin muodossa niiden vaaran hallitsemiseksi.
Lisäksi hydroreita on käytetty vedyn ja lämpötila -anturien puhdistamiseen ja erottamiseen.
Kuivut
Kalsiumhydridiä käytetään orgaanisissa liuottimissa olevan veden poistamiseen.
Hapot ovat peräisin molekyylihydrorista
Esimerkiksi: Kloorivetyhappo muodostuu liuoksella kloorihydridin (HCL) vesipitoisessa väliaineessa käyttämällä suolahappoa rautaa peittävien oksidien eliminoinnissa, öljykaivojen happamoitumisessa, kalsiumin ja mineraalikäsittelyn kloridin tuotannossa.
Lannoitteet
Ammoniakki (NH3) Se on hydridi, jota käytetään nestemäisenä lannoitteena ja joka palvelee ammoniumnitraatin ja ammoniumsulfaatin yhdisteiden synteesiä, joita käytetään lannoitteina.
Vettä
On tärkein hydridi. Sitä käytetään monilla toimialoilla, joilla on erilaisia käyttötarkoituksia ja sovelluksia. Vesi on tärkein vastuussa elävien olentojen olemassaolosta.
Esimerkkejä hydrorista
Lopuksi, muut hydrorien esimerkit luetellaan niiden kaavoilla ja nimillä:
SNH4: Tinan hydridi | PH3: fosforihydridi (fosfiini) tai fosfori -trihydridi |
KH: Lyijy hydridi | MGH2: Magnesium hydridi tai magnesium dihydruro |
KH: Kaliumhydridi | CH4: Carruro Carruro tai hiilitetrahydridi (metaani) |
CAH2: Kalsiumhydridi | FEH2: Rautahydridi (II) |
NAH: Natriumhydridi | ZnH2: Sinkkihydridi |
LIH: litiumhydridi | BAH2: Barium -hydridi |
CSH: Cesium -hydridi | BH3: Boron Hydro (BAS |
BED2: Beryl tai Beryl -dihydridihydridi | SIH4: Piilydro (Silan) |
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wojes, Ryan. (27. elokuuta 2020). Mikä on metallihydridi? Toipunut: Admingco.com
- Amerikkalaiset elementit. (2020). Hydrididit. Haettu: Amerikkalaiset.com
- Wikipedia. (2020). Hydridi. Haettu: vuonna.Wikipedia.org
- Tandis arani. (15. elokuuta 2020). Hydrididit. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Enyclopaedia Britannica -toimittajat. (2020). Hydridi. Toipunut: Britannica.com