Alumiinihydroksidirakenne, ominaisuudet, käytöt, riskit
- 2126
- 364
- Edgar VonRueden
Hän alumiinihydroksidi Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on (OH)3. Toisin kuin muut metallihydroksidit, se on amfotero, joka pystyy reagoimaan tai käyttäytymään kuin happo tai emäs, väliaineesta riippuen. Se on melko liukenematon valkoinen kiinteä aine vedessä, joten se löytää käyttöä antasidien komponenttina.
Kuten Mg (OH)2 tai brucita, jolla sillä on tiettyjä kemiallisia ja fysikaalisia ominaisuuksia, näyttää puhtaasti amorfiselta ja kiiltävältä kiinteältä; Mutta kun kiteytyvät joidenkin epäpuhtauksien kanssa hankkii kiteisiä muotoja ikään kuin ne olisivat helmiä. Näiden mineraalien joukossa AL: n luonnolliset lähteet (OH)3, on gibbsita.
 Erityinen Gibbsita -kristalli. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Erityinen Gibbsita -kristalli. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Gibbsiitin lisäksi ovat myös Bayeriitti-, Nordstrandiitti- ja Doleyíta -mineraalit, jotka muodostavat neljä alumiinihydroksidipolymorfia. Rakenteellisesti ne ovat hyvin samankaltaisia toistensa kanssa, erottaen toisiaan tapaan, kuinka kerrokset tai ionilevyt sijaitsevat tai kytkeytyvät, samoin kuin sisältävien epäpuhtauksien tyyppi.
PH- ja synteesiparametrien ohjaaminen mikä tahansa näistä polymorfista voidaan valmistaa. Samoin jotkut kiinnostavat kemialliset lajit voidaan väliaikaista niiden kerrosten väliin, niin että väliaikaiset materiaalit tai yhdisteet luodaan. Tämä edustaa teknologisen lähestymistavan käyttöä AL: lle (OH)3. Sen muut käyttötarkoitukset ovat kuin antasidit.
Toisaalta sitä käytetään raaka -aineena alumiinioksidin saamiseksi, ja sen nanohiukkasia on käytetty katalyyttisenä tukena.
[TOC]
Rakenne
Kaava ja Octaedro
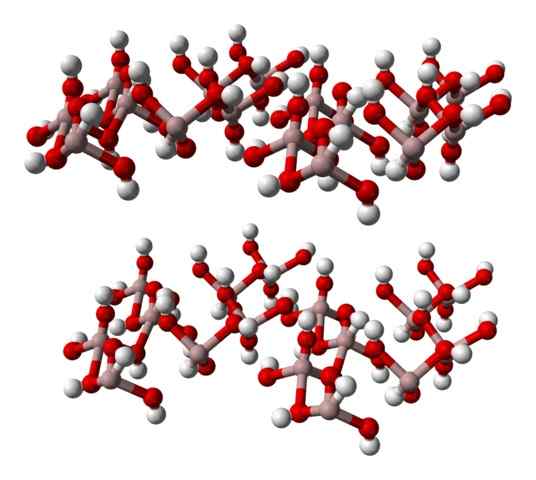
Kemiallinen kaava kohdassa (OH)3 osoittaa, että suhde3+: Vai niin- Se on 1: 3; eli on kolme anionia OH- jokaiselle kationille3+, mikä on sama kuin sanoa, että sen ionien kolmas osa vastaa alumiinia. Joten, Al3+ ja oh- He ovat vuorovaikutuksessa sähköstaattisesti, kunnes heidän nähtävyytensä repuulokset määrittelevät kuusikulmainen kide.
Kuitenkin Al3+ Sitä ei välttämättä ympäröi kolme OH: ta- mutta kuusi; Siksi on puhetta koordinaatio oktaedronista, (OH)6, jossa on kuusi vuorovaikutusta al-o. Jokainen oktaedroni edustaa yksikköä, jonka kanssa lasi on rakennettu, ja monet heistä omaksuvat trikliiniset tai monokliiniset rakenteet.
Alempi kuva edustaa osittain oktaedraa (OH)6, koska havaitaan vain neljä vuorovaikutusta3+ (vaaleanruskeat pallot).
 Gibbsite -kuusikulmainen lasi, alumiinihydroksidimineraali. Lähde: Benjah-BMM27 [julkinen alue].
Gibbsite -kuusikulmainen lasi, alumiinihydroksidimineraali. Lähde: Benjah-BMM27 [julkinen alue]. Jos tätä rakennetta havaitaan huolellisesti, mikä vastaa Gibbsite -mineraalin rakennetta, voidaan harkita, että valkoiset pallot integroivat ionikerrosten ”pinnat” tai pinnat; Nämä ovat OH -ionien vetyatomeja-.
Voi palvella sinua: vuokraa halogeenuros: ominaisuudet, hankkiminen, esimerkkejäHuomaa, että on olemassa kerros A ja toinen B (alueellisesti eivät ole identtisiä) yhdessä toistensa kanssa vety silloilla.
Polymorfit
Kerroksia A ja B ei aina kytke kytkettynä samalla tavalla, samoin kuin niiden fyysiset ympäristöt tai vieras -ionit (suolat) voivat muuttua. Tämän seurauksena Al (OH) kiteet3 Ne vaihtelevat neljässä mineralogisessa muodossa tai tässä tapauksessa polymorfisia.
Sitten sanotaan, että alumiinihydroksidilla on jopa neljä polymorfia: gibbsiitti tai hydragilite (monokliininen), bayeriitti (monokliininen), Doyleíta (triscycling) ja Nordstrandiitti (trikliininen). Näistä polymorfeista Gibbsita on vakain ja runsas; Muut luokitellaan harvinaisiksi mineraaleiksi.
Jos kiteitä havaitaan mikroskoopissa, nähdään, että heidän geometria on kuusikulmainen (vaikkakin hieman epäsäännöllinen). PH: lla on tärkeä rooli tällaisten kiteiden kasvussa ja siitä johtuvassa rakenteessa; ts.
Esimerkiksi, jos väliaine, jossa al (OH) saostuu3 Sen pH on muodostettu alle 5,8 Gibbsitaa; Vaikka pH on suurempi kuin tämä arvo, Bayerita muodostuu.
Perusvälineissä Nordstrandita ja Doyleíta -kiteet yleensä muodostuvat. Siten, koska se on runsas gibbsiitti, se heijastaa sen sääympäristöjen happamuutta.
Ominaisuudet
Fyysinen ulkonäkö
Valkoinen kiinteä aine, joka voi tulla eri muodoissa: rakeistettu tai jauhe ja amorfinen ulkonäkö.
Moolimassa
78.00 g/mol
Tiheys
2,42 g/ml
Sulamispiste
300 ° C. Sillä ei ole kiehumispistettä, koska hydroksidi menettää vettä muuttumaan alumiinioksidiksi tai alumiinioksidiksi,2JOMPIKUMPI3.
Vesiliukoisuus
1 · 10-4 G/100 ml. Sen liukoisuus kasvaa kuitenkin lisäämällä happoja (H3JOMPIKUMPI+) tai alkalis (OH--A.
Liukoisuustuote
K -k -SP = 3 · 10−34
Tämä pieni arvo tarkoittaa, että vain pieni osa liukenee veteen:
Al (OH)3(suola3+(AC) +3OH-(AC)
Ja itse asiassa tämä halveksittava liukoisuus tekee siitä hyvän happamuuden neutraloijan, koska se ei perusta mahalaukun ympäristöä liikaa, jotta melkein ionit eivät vapauttaisi OH-.
Antfoteerismi
Al (OH)3 Sille on ominaista sen amfoterihahmo; eli se voi reagoida tai käyttäytyä ikään kuin se olisi happo tai emäs.
Esimerkiksi reagoi H -ionien kanssa3JOMPIKUMPI+ (Jos väliaine on vesipitoinen) kompleksin ACUO: n muodostamiseksi [OH2-A6-3+; joka puolestaan hydrolysoidaan ympäristön happamiseksi, siksi Al3+ happo -ioni:
Voi palvella sinua: Cannizzaro -reaktio: Ominaisuudet, mekanismit, esimerkitAl (OH)3(s) +3H3JOMPIKUMPI+(AC) => [Al (OH2-A6-3+(AC)
[Al (Voi2-A6-3+(AC) +H2Tai (l) [al (OH2-A5(Vai niin)]2+(AC)+H3JOMPIKUMPI+(AC)
Kun tämä tapahtuu, sanotaan, että Al (OH)3 Se käyttäytyy kuin pohja, koska se reagoi H: n kanssa3JOMPIKUMPI+. Toisaalta voit reagoida OH: n kanssa-, käyttäytyminen kuin happo:
Al (OH)3(S) +OH-(AC) => AH (OH)4-(AC)
Tässä reaktiossa AL: n valkoinen sakka (OH)3 Se liukenee ionien ylimääräiseen OH-; Tosiasia, jota ei tapahdu samalla tavalla muiden hydroksidien, kuten magnesiumin, mg (OH) kanssa2.
Al (OH)4-, Aluminaatti -ioni, se voidaan ilmaista asianmukaisemmin seuraavasti: [Al (OH2-A2(VAI NIIN)4--, korostamalla 6: n koordinointinumeroa kationille3+ (Octaedro).
Tämä ioni voi jatkaa reagoimista enemmän OH- kunnes koordinointi oktaedroni: [Al (OH)6-3-, nimeltään Hexahidroksoaluminate -ioni.
Nimikkeistö
Nimi 'Alumiinihydroksidi', joka on eniten viitannut tähän yhdisteeseen, vastaa osakekannan hallintaa. (III) jätetään sen lopussa pois, koska alumiinin hapettumistila on +3 kaikissa sen yhdisteissä.
Kaksi muuta mahdollista nimeä viitataan AL: ään (OH)3 Ne ovat: alumiini -trihydroksidi systemaattisen nimikkeistön ja kreikkalaisten numeroijien käytön mukaan; ja alumiinihydroksidi, päättyen jälkiliitteeseen -cossa yhdellä hapettumistilalla.
Vaikka kemiallisella kentällä Al (OH) -nimikkeistö3 Se ei edusta haasteita tai sekaannusta, sen ulkopuolella on taipumus sekoittaa epäselvyyksiin.
Esimerkiksi Gibbsita Mineral on yksi AL: n luonnollisista polymorfeista (OH)3, johon ne nimeävät myös γ-al (OH)3 tai α-al (OH)3. Kuitenkin α-al (OH)3 Se voi myös vastata Bayerita-mineraalia tai β-al (OH)3, Kristallografisen nimikkeistön mukaan. Samaan aikaan Nordstrandita- ja Doyleita -polymorfit on yleensä nimetty nimellä (OH)3.
Seuraava luettelo on selvästi yhteenveto äskettäin selitetystä:
-Gibbsita: (γ tai α) -al (OH)3
-Bayerita: (α tai β) -al (OH)3
-Nordstrandita: Al (OH)3
-Doyleita: Al (OH)3
Sovellukset
Raaka materiaali
Alumiinihydroksidin välitön käyttö on raaka -ainetta alumiinioksidien tai muiden yhdisteiden, epäorgaanisten tai orgaanisten, alumiinin tuottamiseksi; Esimerkiksi: Alcl3, Ei3-A3, Alf3 tai Naal (OH)4.
Katalyyttiset tuet
Al (OH) nanohiukkaset3 Ne voivat toimia katalyyttisinä tuina; Eli katalyytti liittyy niihin kiinnitettäväksi pintaansa, missä kemialliset reaktiot kiihdytetään.
Voi palvella sinua: synteesireaktio: Tyypit, tekijät, esimerkitKansainväliset yhdisteet
Rakenneosassa selitettiin, että Al (OH)3 Se koostuu kerroksista tai arkeista A ja B, kytkettynä kristallin määrittelemiseksi. Sen sisällä on pieniä oktaedrisia tiloja tai onttoja, jotka voivat miehittää muut ionit, metalliset tai orgaaniset tai neutraalit molekyylit.
Kun kiteitä syntetisoidaan (OH)3 Näillä rakenteellisilla modifikaatioilla sanotaan, että interkalaatioyhdiste on valmistettu; eli välitä tai laittaa kemiallisia lajeja arkkien a ja b väliin. Näin tehdyssä uudet tästä hydroksidista valmistetut materiaalit.
Palonestoaine
Al (OH)3 Se on hyvä palonestoaine, joka löytää sovelluksen monien polymeerimatriisien täyttömateriaalina. Tämä johtuu siitä, että se imee lämpöä vesihöyryn vapauttamiseksi, kuten Mg (OH)2 tai brucita.
Lääketieteellinen
Al (OH)3 Se on myös neutraloiva happamuus, joka reagoi mahalaukun eritteiden HCL: n kanssa; Jälleen samanlainen kuin miten se tapahtuu Mg: n kanssa (OH)2 Magnesia -maitoa.
Molemmat hydroksidit voidaan sekoittaa erilaisiin antasideihin, joita käytetään lievittämään gastriitista tai mahahaavoista kärsivien ihmisten oireita.
Adsorbentti
Kun sitä lämmitetään sulamispisteen alapuolella, alumiinihydroksidi muuttuu aktivoituneeksi alumiinioksidiksi (samoin kuin aktivoitu hiili). Tätä kiinteää ainetta käytetään ei -toivottujen molekyylien, joko väriaineiden, epäpuhtauksien tai saastuttavien kaasujen adsorbenttina.
Riskejä
Alumiinihydroksidia edustavat riskit eivät johdu siitä kiinteänä, vaan lääkkeenä. Sen säilyttämiseksi ei tarvita protokollaa tai säädöksiä, koska se ei reagoi voimakkaasti hapettavien aineiden kanssa, eikä se ole myös syttyvää.
Kun nautitaan apteekkeissa saavutettuihin antasideihin, ei -toivotut sivuvaikutukset voivat esiintyä, kuten ummetus ja suoliston fosfaatin estäminen. Lisäksi, ja vaikka sen osoittamiseksi ei ole tutkimuksia, se on liittynyt neurologisiin häiriöihin, kuten Alzheimerin tauti.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Hydroksidi -alumiini. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2019). Hydroksidi -alumiini. Pubchem -tietokanta. CID = 10176082. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Danielle Reid. (2019). Hydroksidialumiini: kaava ja sivuvaikutukset. Opiskelu. Toipunut: Opiskelu.com
- Robert Schoen & Charles ja. Roberson. (1970). Alumiinihydroksidin rakenteet ja geokemialliset vaikutukset. Amerikkalainen mineralogisti, osa 55.
- Vitaly P. ISUpov & Col. (2000). Alumiinihydroksidien interkalaatioyhdisteiden synteesi, rakenne, ominaisuudet ja käyttö. Kestävän kehityksen kemia 8 121-127.
- Huumeet. (24. maaliskuuta 2019). Alumiinihydroksidin sivuvaikutukset. Toipunut: Huumeet.com
- « Vanadion historia, ominaisuudet, rakenne, käyttää
- Nikkelihistoria, ominaisuudet, rakenne, käyttö, riskit »

