Strontiumhydroksidi (SR (OH) ₂)

- 3769
- 437
- Alonzo Kirlin
 Strontiumhydroksidi
Strontiumhydroksidi Mikä on strontiumhydroksidi?
Hän Strontiumhydroksidi (SR (OH) ₂) on epäorgaaninen kemiallinen yhdiste, jonka muodostaa strontiumioni (SR) ja kaksi hydroksidi -ionia (OH). Tämä yhdiste saadaan yhdistämällä strol -suola voimakkaan emäksen kanssa, mikä johtaa alkaliseen luonteeseen, jonka kemiallinen kaava on SR (OH)2.
Yleensä strontiumhydroksidin valmistukseen käytetään natriumhydroksidia (NaOH) tai kaliumhydroksidia (KOH). Toisaalta strontiumsuola (tai strontium -ioni), joka reagoi vahvan emäksen kanssa, on strontium Sr: n nitraatti (ei3-A2 Ja prosessi kuvataan seuraavalla kemiallisella reaktiolla:
2KOH + SR (ei3-A2 → 2KNO3 + SR (OH)2
Liuoksessa strontiumkationi (SR+) Hän ottaa yhteyttä hydroksidianioniin (OH-) muodostaen emäksisen ionisen strontiumsuolan. Koska strontium on emäksinen metalli, strontiumhydroksidia pidetään kaustisena alkaliyhdisteenä.
Strontiumhydroksidin hankkiminen
Aikaisemmin selitetyn prosessin lisäksi voidaan sanoa, että kun reaktio on suoritettu, SR (OH)2 sade liuoksessa. Sitten tähän altistetaan pesu- ja kuivausprosessi, saaden lopulta erittäin hienon valkoisen jauheen.
Vaihtoehtoinen menetelmä strontiumhydroksidin saamiseksi on strontiumkarbonaatin kuumentamisesta (SRCO3) tai strontiumsulfaatti (SRSO4), höyryn ollessa lämpötilassa välillä 500 ° C - 600 ° C. Kemiallinen reaktio tapahtuu alla esitetyllä tavalla:
SRCO3 + H2O → SR (OH)2 + Yhteistyö2
SRS + 2H2O → SR (OH)2 + H2S
Voi palvella sinua: RikkihappoKemiallinen rakenne ja fysikaalis -kemialliset ominaisuudet
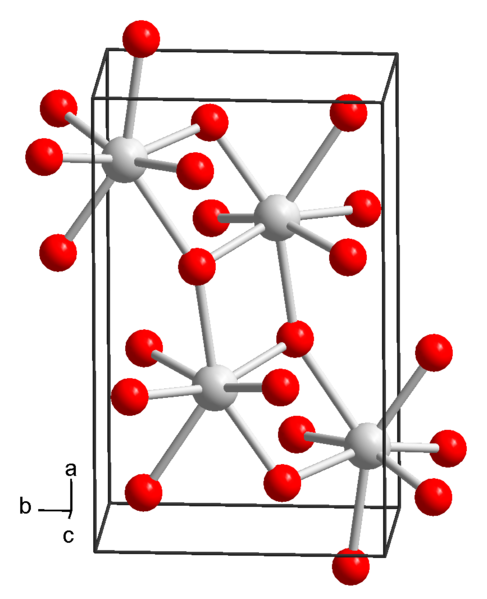 Strontiumhydroksidin kemiallinen rakenne. Lähde: Wikimedia Commons
Strontiumhydroksidin kemiallinen rakenne. Lähde: Wikimedia Commons Tällä hetkellä tunnetaan 3 strontiumhydroksidin muotoa: oktahydraatti, monohydraatti ja vedettömät.
Oktonattu strontiumhydroksidi
Normaalilämpötila- ja paine -olosuhteissa (25 ° C ja 1 atm) liuoksista strontiumhydroksidi saostuu oktaysdraattisella tavalla, jonka kemiallinen kaava on SR (OH)2∙ 8H2JOMPIKUMPI.
Tämän yhdisteen molaarimassa on 265,76 g/mol, tiheys 1,90 g/cm ja saostuu tetragonalikiteinä (alueellisella ryhmällä P4/NCC) neljännesten prismaisen ulkonäön ja värittömänä.
Samoin oktonisoidulla strontiumhydroksidilla on kyky imeä ilmakehän kosteutta, koska se on helposti herkullinen yhdiste.
Monohydratoitu strontiumhydroksidi
Optisten mikroskopiatutkimusten mukaan (suoritettu x -diffraktiotekniikalla) nostamalla lämpötila noin 210 ° C: seen - vakio ilmakehän paine - SR (OH)2∙ 8H2O Se on kuivunut ja transformoitu monohydratoituneeksi strontiumhydroksidiksi (SR (OH)2H2JOMPIKUMPI).
Tämän yhdisteen muodon molaarimassa on 139,65 g/mol ja sen sulamislämpötila on -73,15 ° C (375k). Atomien konfiguraationsa vuoksi tämä aiheuttaa vähemmän liukoisuutta vedessä kuin sen oktaydraattimuodossa kuvailtu.
Vedetön strontiumhydroksidi
Jatkamalla järjestelmän lämpötilan nousua noin 480 ° C: seen, dehydraatio jatkuu, kunnes vedetöntä venytyshydroksidia.
Toisin kuin sen hydratoituneet muodot, sen molaarimassa on 121,63 g/mol ja tiheys 3 625 g/cm3. Sen kiehumispiste on saavutettu 710 ° C: ssa (1 310 ° F tai 983 K), kun taas sulamispiste on 535 ° C: ssa (995 ° F tai 808 K).
Voi palvella sinua: Ididio 192Liukoisuus
Strontium oktahydraattihydroksidin veden liukoisuus on 0,91 grammaa 100 millilitraa kohti (mitattu 0 ° C: ssa), kun taas sen vedettömän muodon samanlaisissa lämpötilaolosuhteissa liukoisuus on 0,41 grammaa 100 millilitraa kohden.
Samoin tätä ainetta pidetään liukenemattomana asetoniin ja liukenee kokonaan hapoihin ja ammoniumkloridiin.
Kemiallinen reaktiivisuus
Strontiumhydroksidi ei ole syttyvää, sen kemiallinen reaktiivisuus pysyy vakaana kohtalaisissa lämpötiloissa ja paineissa ja pystyy absorboimaan hiilidioksidia ilmakehän ilmasta muuttamalla sen strontiumkarbonaatiksi.
Lisäksi se on vakavasti ärsyttävä yhdiste, jos otat yhteyttä ihoon, hengitysteiden tai muiden limakalvoihin.
Strontiumhydroksidi käyttää
Hygroskooppisten ominaisuuksiensa ja perusominaisuuksiensa vuoksi strontiumhydroksidia käytetään alan eri sovelluksiin:
- Moice -uutto ja sokerin puhdistus juurikkaasta.
- Muovivakain.
- Rasvat ja voiteluaineet.
Moice -uutto ja juurikas sokerin hienosäätö
2000 -luvun alussa, Saksassa, venytyshydroksidia alettiin käyttää juurikkaiden jalustan puhdistamiseen Carl Scheiblerin patentoidun prosessin kautta vuonna 1882.
Tämä toimenpide koostuu strontiumhydroksidin ja sokerijuurikkaan sokerin seoksesta, mikä johtaa liukenemattomaan disakkaridiin. Tämä ratkaisu erotetaan dekantoinnilla ja kun puhdistusprosessi on suoritettu, sokeri saadaan lopputuotteena.
Vaikka tätä toimenpidettä käytetään edelleen, on muitakin menetelmiä, joilla on paljon enemmän halvempaa kysyntää, joita käytetään valtaosassa maailman sokerin jalostamoista. Esimerkiksi Barsil -menetelmä, joka käyttää bariumsilikaattia tai Steffen -menetelmää, käyttämällä kalkkia uuttoaineena.
Voi palvella sinua: anomeerinen hiili: Mikä on, ominaisuudet, esimerkitStrontiumrasvat
Ne voitelee rasvoja, jotka sisältävät strontiumhydroksidia. Nämä kykenevät tarttumaan voimakkaasti metalliominaisuuksilla oleviin pintoihin, ovat vedenkestävää ja tukemaan äkillisiä lämpötilan muutoksia.
Hyvän fysikaalisen ja kemiallisen stabiilisuuden vuoksi näitä rasvoja käytetään teollisuusvoiteluaineena.
Muovivakain
Valta.
Näihin polymeereihin lisätään huomattavan vedenkestävyytensä vuoksi strontiumhydroksidia - fuusiofaasin aikana - toimii stabilointina muovituotteiden valmistuksessa sen käyttöiän pidentämiseksi.
Muut sovellukset
- Maaliteollisuudessa sitä käytetään välttämättömänä lisäaineena kuivausprosessin nopeuttamiseksi kaupallisissa ja teollisissa maalauksissa.
- Strontiumhydroksidista, suolat tai strontiumioneja saadaan, joita käytetään raaka -aineena pyrotekniikan artikkeleiden tuotantoon.
Viitteet
- Wikipedia (n.d -d.-A. Strontiumhydroksidi. Haettu jstk.Wikipedia.org
- Pubchem (S.F.-A. Strontiumhydroksidi. Saatu Pubchemista.NCBI.Nlm.NIH.Hallitus
- Honeywell (S.F.-A. Sontoniumhydroksidi oktahydraatti. Haettu Honeywellistä.com

