Magnesiumhydroksidirakenne, ominaisuudet, nimikkeistö, käyttää

- 4951
- 954
- Gabriel Fahey
Hän magnesiumhydroksidi Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on Mg (OH)2. Puhtaan muodossaan se on valkoinen kiinteä kiinteä ilman kirkkautta ja amorfista ulkonäköä; Pienellä ja tarkalla epäpuhtauksien pitoisuudella se muuttuu kuitenkin kiteiseksi kiinteäksi brucitaksi, mineraaliksi, joka on tietyissä luonnon talletuksissa ja on rikas magnesiumlähde.
Se on heikko elektrolyytti tai emäs, joten sen dissosiaatio on vähän vettä. Tämä ominaisuus tekee Mg: stä (OH)2 hyvä happamuus neutraloija ihmisravinnolle; Suosittu lääke maidon suspensiona magnesiasta. Se on myös palonestoaine vapauttamalla vettä sen lämpöhajoamisen aikana.
 Kiinteä magnesiumhydroksidinäyte. Lähde: ChemicalInterest [julkinen alue]
Kiinteä magnesiumhydroksidinäyte. Lähde: ChemicalInterest [julkinen alue] Yläkuvassa esitetään joitain magnesiumhydroksidin kiinteitä aineita, joissa sen läpinäkymätön valkoinen väri voidaan nähdä. Mitä kiteisempiä he ovat, ne kehittävät lasimaisia ja helmiäispintoja.
Sen kiteinen rakenne on erikoinen, koska se muodostaa kaksoiskerroksen kuusikulmaiset kiteet, jotka ovat lupaavia malleja uusien materiaalien suunnittelulle. Näissä kerroksissa niiden positiivisilla kuormilla on tärkeä rooli MG: n korvaamisen vuoksi2+ kolmiulotteisilla kationilla ja lajeilla, jotka on rajoitettu OH -anioneista koostuvien seinien väliin-.
Toisaalta muut sovellukset johtuvat valmistettujen hiukkasten tai nanohiukkasten morfologiasta riippuen; katalyytit tai adsorbentit. Kaikissa niissä Mg -ionien suhde 1: 2 on vakiona2+: Vai niin-, heijastuu samassa MG -kaavassa (OH)2.
[TOC]
Rakenne
Kaava ja Octaedro
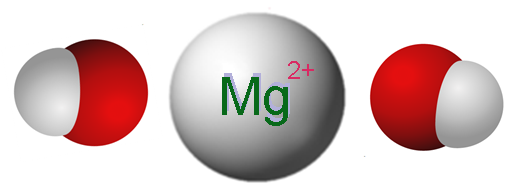 Ionit, jotka muodostavat magnesiumhydroksidin. Lähde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Ionit, jotka muodostavat magnesiumhydroksidin. Lähde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Ylivoimainen kuva näyttää ionit, jotka muodostavat Mg (OH)2. Kuten voidaan nähdä, on kaksi anionia OH- Jokaiselle kationille mg2+, jotka ovat vuorovaikutuksessa sähköstaattisesti määrittelemään kuusikulmainen rakennekite. Sama kaava osoittaa, että MG -suhde: OH on 1: 2.
Todellinen kiteinen rakenne on kuitenkin hiukan monimutkaisempi kuin olettaa yksinkertaisia Mg -ioneja2+ ja oh-. Itse asiassa magnesiumille on ominaista, että koordinaationumero 6, joten se voi olla vuorovaikutuksessa jopa kuuden OH: n kanssa-.
Siten oktaedron Mg (OH) muodostuu6, missä happiatomit tulevat ilmeisesti OH: sta-; Ja kiteinen rakenne perustuu nyt tällaisen oktaedran huomioon ottamiseen ja siihen, kuinka ne ovat vuorovaikutuksessa toistensa kanssa.
Itse asiassa Mg (OH) -yksiköt6 Ne lopulta määrittelevät kaksoislayserirakenteet, jotka puolestaan tilataan avaruudessa aiheuttamaan kuusikulmainen lasia.
Voi palvella sinua: atomipainoKaksikerros
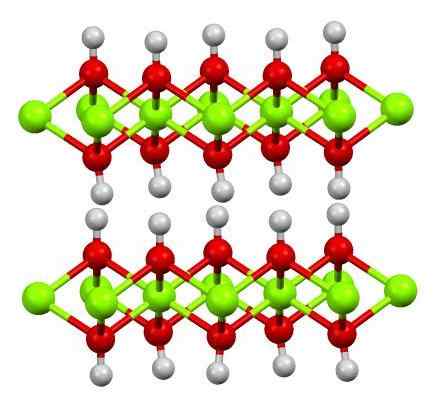 Kaksinkertainen kerros magnesiumhydroksidia. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Kaksinkertainen kerros magnesiumhydroksidia. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Yläkuva näyttää magnesiumhydroksidin (LDH) kaksikerroksen Kerrostettu kaksoishydroksidit-A. Vihreät pallot edustavat Mg -ioneja2+, jotka voitaisiin korvata muilla suuremmalla kuormituksella positiivisen kuorman tuottamiseksi kerroksessa.
Huomaa, että jokaisen Mg: n ympärillä2+ Niiden valkoisiin palloihin on kytketty kuusi punaista palloa; eli oktaedriset yksiköt mg (OH)6. VAI NIIN- Se toimii siltana liittyäkseen kahteen mg2+ eri tasot, mikä tekee kerrokset rajoittumaan.
Samoin havaitaan, että vetyatomit osoittavat ylös ja alas ja ovat ensimmäisiä vastuussa molekyylien välisistä voimista, jotka pitävät MG (OH) -yksiköiden kaksi kerrosta yhdessä6.
Näistä kerroksista neutraalit molekyylit (kuten alkoholit, ammoniakki ja typpi) tai jopa anionit riippuen siitä, kuinka positiivisia ne ovat (jos ioneja on3+ tai usko3+ MG: n korvaaminen2+-A. Näiden lajien "täyte" rajoittuvat OH -anioneista koostuvat pinnat-.
Morfologiat
Kuusikulmainen ja kaksinkertainen lasi kasvaa hitaasti tai nopeasti. Kaikki riippuu synteesi- tai valmistusparametreista: lämpötila, molaarinen suhde, levottomuus, liuottimet, reagenssit magnesiumin, emäksen tai saostuvien aineiden jne. Lähteenä jne. Lasin kasvaessa määrittele nanohiukkasten tai aggregaattien mikrorakenne tai morfologia.
Siten näissä nanohiukkasissa voi olla ruokia, verihiutaleita tai kukkakaalia. Samoin sen koon jakautuminen voi muuttua, samoin kuin tuloksena olevien kiinteiden aineiden huokoisuuden aste.
Ominaisuudet
Fyysinen ulkonäkö
Se on valkoinen, rakeistettu tai jauhettu kiinteä ja wc.
Moolimassa
58 3197 g/mol.
Tiheys
3,47 g/ml.
Sulamispiste
350 ºC. Tässä lämpötilassa se hajoaa oksidissa vapauttamalla kiteisiin sisältyvät vesimolekyylit:
Mg (OH)2(s) => mggo (s) +h2O (g)
Vesiliukoisuus
0,004 g/100 ml 100 ° C: ssa; Eli se tuskin onnistuu liukenemaan kiehuvaan veteen, joten se on liukenematon yhdiste vedessä. Kuitenkin vähentämällä pH: ta (tai lisäämällä happamuutta) sen liukoisuutta lisääntyy kompleksin ACUO: n, MG: n muodostumisella (OH2-A6.
Toisaalta, jos MG (OH)2 on absorboinut CO: n2, vapauttaa kaasun, joka on pidetty poreiluna, kun se liukenee happamaan väliaineeseen.
Voi palvella sinua: Helium: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetTaitekerroin
1 559
PHE
Vesipitoisessa suspensiossa on pH, joka vaihtelee välillä 9,5 - 10,5. Vaikka nämä arvot ovat normaaleja, se heijastaa sen pientä emäksisyyttä muita metallihydroksideja vastaan (kuten NaOH).
Lämpökapasiteetti
77.03 j/mol · k
Missä se sijaitsee?
 Sininen brucita sininen blut. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Sininen brucita sininen blut. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Magnesiumhydroksidia löytyy luonnosta brucita -mineraalina, jolle on ominaista sen läpinäkyvä valkoinen väri, vihreät tai sinertävät sävyt sen epäpuhtauksista riippuen. Samoin brucita on osa joitain savia, kuten kloriitti, kun silikaattikerrosten välissä on metalli -ionien yhdistäminen.
La Brucitassa on muita ioneja MG: n lisäksi2+, kuten Al3+, Usko3+, Zn2+ ja Mn2+. Heidän menoja löytyy Skotlannin, Kanadan, Italian ja Yhdysvaltojen eri alueilta tai järvistä.
Fyysisesti heidän kiteensä näkevät.
Tämä mineraali on yksi pahoista, jotka vaikuttavat sementteihin ja betoniin, koska sillä on taipumus laajentua ja aiheuttaa niihin murtumia. Se ei kuitenkaan absorboi CO: ta2, Joten sen kalsinointi ei vaikuta kasvihuonevaikutukseen, ja siksi se on sopiva mineraloginen lähde (ja rikkain) magnesiumin saamiseksi meriveden lisäksi.
Nimikkeistö
Mg (OH)2 Sillä on jopa kolme IUPAC: n hyväksymää nimeä (mineralogiasta tai lääketieteestä). Nämä ovat hyvin samankaltaisia toistensa kanssa, koska aivan kuten ne päättyvät.
Esimerkiksi 'magnesiumhydroksidi' vastaa nimeään varastossa olevan nimikkeistön mukaan, jättäen (ii) lopussa, koska +2 on oletuksena magnesiumin hapettumistila melkein oletuksena.
'Magnesium dihydroksidi', osoittaen kreikkalaisen numeroijan etuliitteen OH -ionien lukumäärän- osoitettu kaavassa systemaattisen nimikkeistön mukaan. Ja 'magneettinen hydroksidi', päättyen jälkiliitteeseen -coon, koska se on maksimaalinen ja "ainutlaatuinen" magnesiumin hapettumistila, perinteisen nimikkeistön mukaan.
Muut nimet, kuten brucita tai magnesiamaito, vaikka ne liittyvät suoraan tähän yhdisteeseen, ei ole kätevää viitata siihen puhtaimpaan kiinteään kiinteään kiinteään tai epäorgaanisena yhdisteenä (reagenssi, raaka -aine jne.-A.
Sovellukset
Neutraloija
Mg (OH)2 Veden alhaisen liukoisuuden vuoksi tosiasia, että se on erinomainen happamuus neutraloija; Muuten väliaine perustaisi, kun se lisää suuria pitoisuuksia OH -ioneja-, Kuten muut emäkset (vahvat elektrolyytit) tekevät.
Voi palvella sinua: kemiallinen hybridisaatioSiten Mg (OH)2 tuskin vapauta OH-, Samanaikaisesti se reagoi H -ionien kanssa3JOMPIKUMPI+ Magnesiumikompleksin muodostamiseksi, myös edellä mainittu. Kyky neutraloida vesipitoisten väliainien happamuuden, se on tarkoitettu jäteveden käsittelyyn.
Se on myös lisäaine ruokaa, lannoitteita ja tiettyjä henkilökohtaisia hygieniatuotteita, kuten hammastahna, koska sen happamuus vähenee.
Antasidi
Koska se on vähän vesiliukoinen, se voidaan ottaa käyttämättä sen OH -ionien vaikutusten riskiä- (hyvin vähän dissosiaatioita, kuten heikko elektrolyytti).
Tämä ominaisuus, joka on liitetty ylhäältä olevaan luvulle, tekee siitä antasidin mahalaukun happamuuden, maha -suolikanavan sairauksien, ruoansulatushäiriöiden ja ummetuksen hoitamiseksi, jota myydään magnesiamaitokaavan alla.
Toisaalta Magnesian maito auttaa myös torjumaan ärsyttäviä kasvoja (suuhun ilmestyvät valkoiset ja punaiset haavaumat).
Palonestoaine
Ominaisuuksien osiossa mainittiin, että Mg (OH)2 Se hajottaa vapauttavan veden. Juuri, tällainen vesi auttaa lopettamaan liekkien edistymisen, koska ne imevät lämpöä höyrystymään ja vuorostaan höyryt laimentavat palavia tai syttyviä kaasuja.
Brucita -mineraalia käytetään yleensä teollisesti tähän tarkoitukseen, joka on tarkoitettu täyttämään tiettyjä materiaaleja, kuten eri polymeerien muovit (PVC, hartsit, kuivet), kaapelit tai katot.
Katalyytti
Mg (OH)2 Nanoplaquetasina syntetisoidut ovat osoittautuneet tehokkaiksi kemiallisten pelkistysten katalysoimiseksi; Esimerkiksi 4-nitrofenoli (ph-ei2) 4-aminofenoli (PH-NH2-A. Heillä on myös antibakteerinen aktiivisuus, joten sitä voidaan käyttää terapeuttisena aineena.
Adsorbentti
Jotkut Mg (OH) kiinteät aineet2 Ne voivat olla melko huokoisia valmistelumenetelmästä riippuen. Siksi he löytävät sovelluksen adsorbentteina.
Vesipitoisissa liuoksissa ne voivat adsorboida (pinnoillaan) väritysmolekyylejä, selventämällä vettä. Esimerkiksi he kykenevät adsorboimaan vesivirtojen indigo -karmiiniväriaineen.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Hydroksidimagnesium. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2019). Hydroksidimagnesium. Pubchem -tietokanta. CID = 14791. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Ametistigalleriat. (2014). Mineraalibrukiitti. Toipunut: galleriat.com
- Henrist et ai. (2003). Magnesiumhydroksidin nanohiukkasten morfologinen tutkimus
- saostettu laimennettuun vesiliuokseen. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K -k -., Muhammad r. S. (2018). Mesohuokoisten magnesiumhydroksidin nanohiukkasten synteesi ja rakenteellinen analyysi tehokkaana katalyyttinä.
- Thimmasandra Narayan Ramesh ja Vani Pavada Sreenivasa. (2015). Indigo -karmiiniväriaineen poistaminen vesiliuoksesta käyttämällä magnesiumhydroksidia adsorbenttina. Journal of Materials, Vol. 2015, artikkeli ID 753057, 10 sivua. doi.org/10.1155/2015/753057
- « Nikkelihistoria, ominaisuudet, rakenne, käyttö, riskit
- Carlos Pellicer -kammion elämäkerta, tyyli, teokset, lauseet »

