Holoentsyymiominaisuudet, toiminnot ja esimerkit
- 3904
- 279
- Alonzo Kirlin
Eräs Holoentsyymi Se on entsyymi, joka muodostuu proteiiniosalla, jota kutsu. Kannattaja tai kofaktori eivät ole aktiivisia, kun ne ovat erikseen; toisin sanoen ne on kytketty.
Siten holoentsyymit ovat yhdistettyjä entsyymejä ja ovat siten katalysaattoreita aktiivisia. Entsyymit ovat eräänlainen biomolekyylit, joiden toiminta lisää periaatteessa solureaktioiden nopeutta. Jotkut entsyymit tarvitsevat muiden molekyylien apua, nimeltään kofaktorit.
 Tuki + kofaktori = holoentsyymi
Tuki + kofaktori = holoentsyymi Kofaktorit täydentävät toisiaan tuella ja muodostavat aktiivisen holoentsyymin, joka suorittaa katalyysin. Ne entsyymit, jotka vaativat tiettyä kofaktoria, tunnetaan konjugoituina entsyymeinä. Näillä on kaksi pääkomponenttia: kofaktori, joka voi olla metallinen (epäorgaaninen) ioni tai orgaaninen molekyyli; Apoentsyymi, proteiiniosa.
[TOC]
Holoentsyymien ominaisuudet
Kannattajat ja kofaktorit muodostavat
Tuki on kompleksin proteiiniosa, ja kofaktorit voivat olla orgaanisia ioneja tai molekyylejä.
Tunnusta monipuoliset kofaktorit
On olemassa erityyppisiä kofaktoreita, jotka auttavat muodostamaan holoentsyymejä. Joitakin esimerkkejä ovat koentsyymejä ja yleisiä vitamiineja, esimerkiksi: B -vitamiini, FAD, NAD+, C -vitamiini -koentsyymi A.
Jotkut kofaktorit, joissa on metalli -ioneja, esimerkiksi kupari, rauta, sinkki, kalsium ja magnesium. Toinen tyyppiset kofaktorit ovat niin kutsuttuja proteesiryhmiä.
Ajallinen tai pysyvä liitto
Kofaktorit voivat yhdistää tuen eri intensiteetillä. Joissakin tapauksissa liitto on heikko ja väliaikainen, kun taas toisissa tapauksissa liitto on niin vahva, että se on pysyvä.
Tapauksissa, joissa ammattiliitto on väliaikainen, kun kofaktori poistetaan holoentsyymistä, siitä tulee uudelleen tukea ja lakkaa olemasta aktiivinen.
Funktio
Holoentsyymi on entsyymi, joka on valmis käyttämään katalyyttistä toimintaa; toisin sanoen tiettyjen kemiallisten reaktioiden kiihdyttämiseksi, jotka syntyvät eri alueilla.
Toiminnot voivat vaihdella holoentsyymin spesifisen vaikutuksen mukaan. Tärkeimpiä on DNA -polymeraasi, jonka tehtävänä on varmistaa, että DNA: n kopio tehdään oikein.
Voi palvella sinua: Ardipithecus: löytö, ominaisuudet, kalloEsimerkkejä yleisistä holoentsyymeistä
RNA -polymeraasi
 3D -polymeraasi -RNA. Lähde: Maria Voigt., CC 4: llä.0, Wikimedia Commons
3D -polymeraasi -RNA. Lähde: Maria Voigt., CC 4: llä.0, Wikimedia Commons RNA -polymeraasi on holoentsyymi, joka katalysoi RNA -synteesin reaktiota. Tämä holoentsyymi on välttämätöntä RNA -ketjujen rakentamiseksi DNA -muottiketjuista, jotka toimivat templaateina transkriptioprosessin aikana.
Sen tehtävänä on lisätä ribonukleotideja kasvavan RNA -molekyylin lopussa 3. Prokaryooteissa RNA -polymeraasituki tarvitsee Sigma 70 -nimisen kofaktorin.
DNA -polymeraasi
 Homiens homo sapiens beeta beeta -DNA -rakenne. Lähde: Yikrazuul, CC BY-SA 3.0, Wikimedia Commons
Homiens homo sapiens beeta beeta -DNA -rakenne. Lähde: Yikrazuul, CC BY-SA 3.0, Wikimedia Commons DNA -polymeraasi on myös holoentsyymi, joka katalysoi DNA -polymerointireaktiota. Tämä entsyymi suorittaa soluille erittäin tärkeän toiminnon, koska se vastaa geneettisen tiedon toistamisesta.
DNA -polymeraasi tarvitsee ionin, jolla on positiivinen varaus, normaalisti magnesiumia, pystyäkseen suorittamaan sen toiminta.
DNA -polymeraasityyppejä on useita tyyppejä: DNA -polymeraasi III on holoentsyymi, jossa on kaksi keskusentsyymiä (Pol III), jokainen kolmen alayksikön yhdiste (α, ɛ ja θ), liukuva puristus, jolla on kaksi beeta -alayksikköä ja kuormakompleksi asetus, jossa on useita alayksiköitä (Δ, τ, γ, ψ ja χ).
Hiilihydraasi
 Hiilihydraasirakenne
Hiilihydraasirakenne Hiilihydraasi, jota kutsutaan myös karbonaatin kuivumisesta, kuuluu holoentsyymien perheeseen, joka katalysoi hiilidioksidin (CO₂) ja veden (H20) nopeaa konversiota bikarbonaatissa (H2CO3) ja protoneissa (H+).
Entsyymi vaatii sinkki -ionin (Zn+2) kofaktorina toiminnan suorittamiseksi. Hiilihydraasin katalysoima reaktio on palautuva, tästä syystä sen aktiivisuutta pidetään tärkeänä, koska se auttaa ylläpitämään happo-emästen tasapainoa veren ja kudosten välillä.
Hemoglobiini
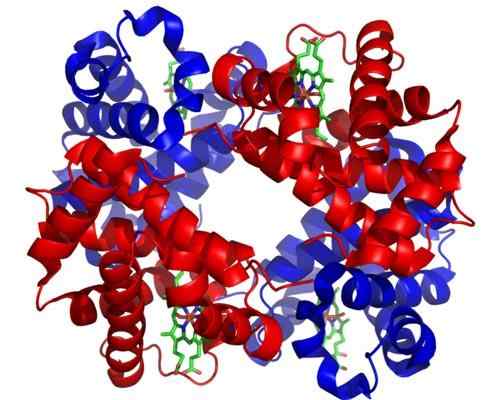 Hemoglobiini
Hemoglobiini Hemoglobiini on erittäin tärkeä holoentsyymi kaasun kuljettamiseen eläinkudoksissa. Tämä punasoluissa läsnä oleva proteiini sisältää rautaa (Fe+2), ja sen tehtävänä on kuljettaa happea keuhkoista muille kehon alueille.
Voi palvella sinua: fotosynteettiset organismitHemoglobiinin molekyylirakenne on tetrameeri, mikä tarkoittaa, että se koostuu 4 polypeptidiketjusta tai alayksiköstä.
Jokainen tämän holoentsyymin alayksikkö sisältää hemo -ryhmän, ja jokainen Hemo -ryhmä sisältää rautatomin, joka voi liittyä happimolekyyleihin. Hemoglobiini Hemo -ryhmä on sen proteesiryhmä, joka on välttämätön sen katalyyttiselle toiminnalle.
Sytokromioksidaasi
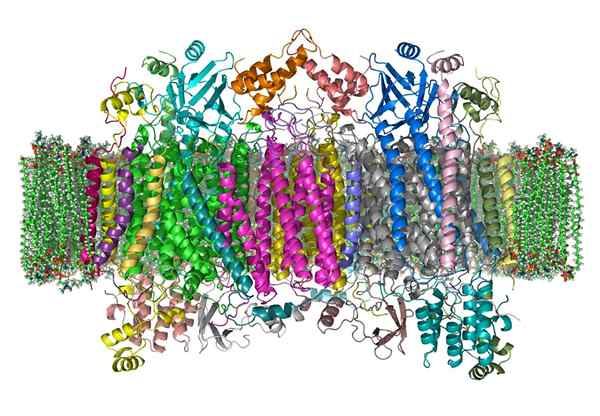 Sytokromioksidaasi
Sytokromioksidaasi Oksidaasisytokromi on entsyymi, joka osallistuu energian hankkimisprosesseihin, jotka suoritetaan melkein kaikkien elävien olentojen mitokondrioissa.
Se on monimutkainen holoentsyymi, joka vaatii tiettyjen kofaktorien, rauta- ja kuparionien yhteistyötä elektroninsiirtoreaktion ja ATP -tuotannon katalysoimiseksi.
Pyruvaattikinaasi
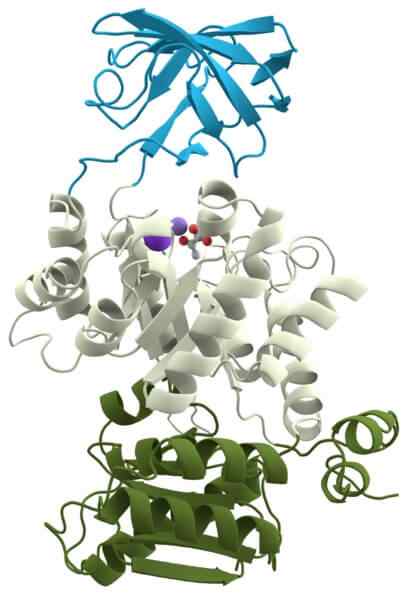 Sytokromioksidaasi
Sytokromioksidaasi Kinaasi -pyruvaatti on toinen tärkeä holoentsyymi kaikille soluille, koska se osallistuu yhteen yleisiin metabolisiin reitteihin: glykolyysi.
Sen tehtävänä on katalysoida molekyylin fosfaattiryhmän siirtoa, jota kutsutaan fosfoenolypyruvaatiksi toiseen molekyyliin, jota kutsu.
Tuki vaatii kaliumkationeja (k ') ja magnesiumia (Mg+2) kofaktoreina funktionaalisen holoentsyymin muodostamiseksi.
Karboksylaasi -pyruvaatti
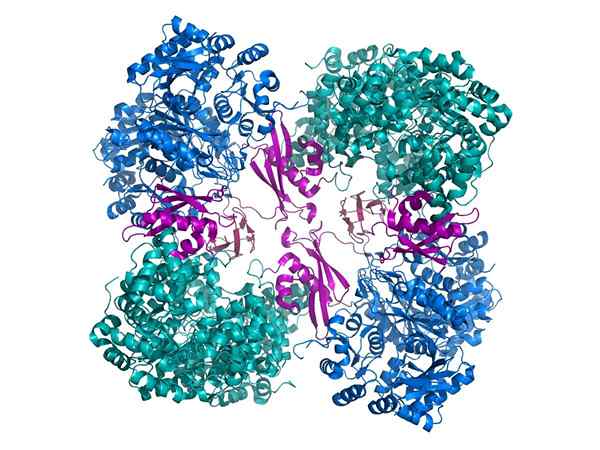 Karboksylaasi -pyruvaatti
Karboksylaasi -pyruvaatti Toinen tärkeä esimerkki on karboksylaasin pyruvaatti, holoenzy. Siten pyruvaatista tulee oksalastaatti, tärkeä välittäjä aineenvaihdunnassa.
Ollakseen toiminnallisesti aktiivinen, foose -karboksylaasi -pyravatoitu vaatii kofaktoria, nimeltään Biotiini.
Asetyyli CoA -karboksylaasi
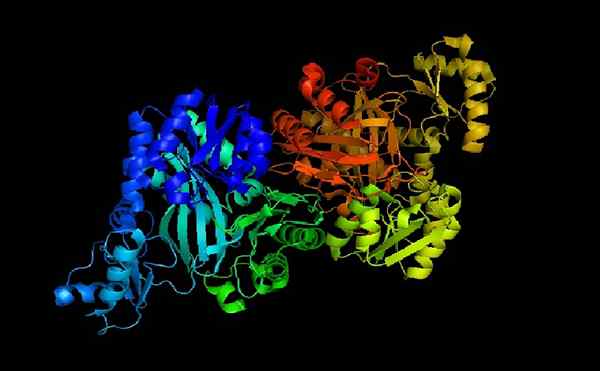 Asetyyli CoA-karboksylaasi E-coli
Asetyyli CoA-karboksylaasi E-coli Asetyyli-CoA-karboksilasi on holoentsyymi, jonka kofaktori, kuten sen nimellä on osoitettu, on koentsyymi.
Kun apoentsyymi ja koentsyymi A on kytketty, holoentsyymi on katalyyttisesti aktiivinen suorittamaan sen toiminto: siirrä karboksyyliryhmä asetyyli-CoA: lle muuttaaksesi sen malonyylikoentsyymi A (malonyyli-CoA).
Voi palvella sinua: Curl: Koostumus, osat, merkitysAsetyyli-CoA suorittaa tärkeitä toimintoja sekä eläinsoluissa että kasvisoluissa.
Oksidaasimonoamiini
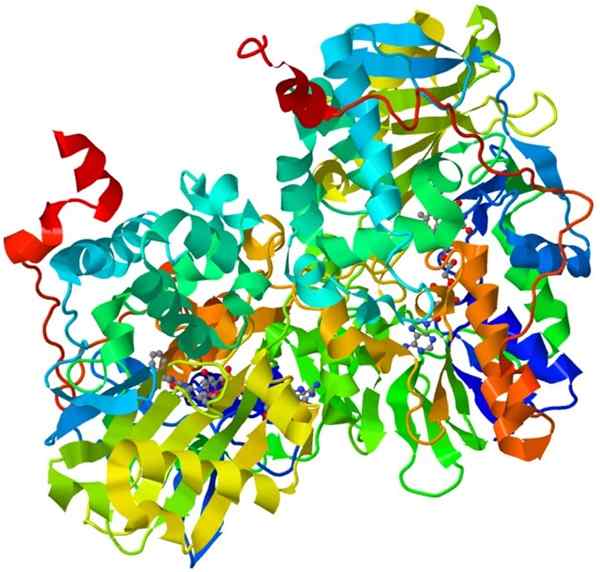 Oksidaasimonoamiinirakenne
Oksidaasimonoamiinirakenne Tämä on tärkeä holoentsyymi ihmisen hermostossa, sen tehtävänä on edistää tiettyjen välittäjäaineiden hajoamista.
Jotta oksidaasimonoamiini olisi katalyyttisesti aktiivinen, sen on kovalenttisesti yhdistättävä kofaktori, flaviinin ja adeniinin dinukleotidi (FAD).
Laktaattidehydrogenaasi
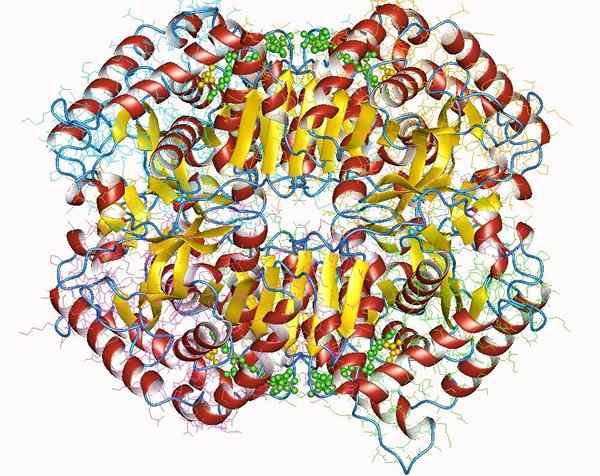 Laktaattidehydrogenaasi
Laktaattidehydrogenaasi Laktaattidehydrogenaasi on tärkeä holoentsyymi kaikille eläville olennoille, etenkin kudoksissa, jotka kuluttavat paljon energiaa, kuten sydän, aivot, maksa, luurankoja, keuhkoja, muun muassa.
Tämä entsyymi vaatii kofaktorin, nikotiinamidin ja adeniinin (NAD) läsnäolon laktaattisen pyruvaatin muuntamisreaktion katalysoimiseksi.
Katalaasi
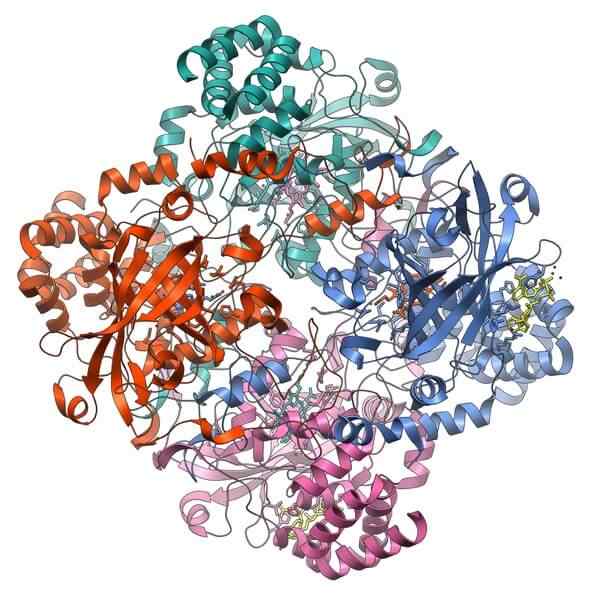 Katalaasiproteiinirakenne. Lähde: Vossman, CC BY-SA 3.0, Wikimedia Commons
Katalaasiproteiinirakenne. Lähde: Vossman, CC BY-SA 3.0, Wikimedia Commons Katalaasi on tärkeä holoentsyymi solujen myrkyllisyyden estämisessä. Sen tehtävänä on hajottaa vetyperoksidi, solujen aineenvaihdunnan tuote, happi ja vesi.
Katalaasin tuki vaatii kaksi kofaktoria aktivoitumaan: mangaani -ioni ja hemo -proteesiryhmä, samanlainen kuin hemoglobiini.
Viitteet
- Athappilly, f. K -k -., & Hendrickson, W. -Lla. (tuhatyhdeksänsataayhdeksänkymmentäviisi). Asetyyli-koentsyymin biotinyylidomeenin rakenne Karboksylaasi määritetty MAD-asteilla. Rakenne, 3(12), 1407-1419.
- Berg, J., Tymoczko, J., Gatto, G. & Strayer, L. (2015). Biokemia (8. ed.-A. W -. H. Freeman ja yritys.
- Fegler, J. (1944). Hiilihydraasin toiminta veressä. Luonto, 137-38.
- Gaweska, h., & Fitzpatrick, P. F. (2011). Monoamiinioksidaasiperheen rakenteet ja mekanismi. Biomolekyyliset käsitteet, 2(5), 365-377.
- Gupta, v., & Bamezai, R. N. K -k -. (2010). Ihmisen pyruvaattikinaasi M2: monitoiminen proteiini. Tiedeproteiini, 19(11), 2031-2044.
- Jitrapakdee, S., St Maurice, M., Rayment, I., Cleland, W. W -., Wallace, J. C., & Attwood, P. V. (2008). Pyruvaattikarboksylaasin rakenne, mekanismi ja säätely. Lehden biokemiallinen, 413(3), 369-387.
- Muirhead, h. (1990). Pyruvaattikinaasin isoentsyymit. Biokemialliset seuran liiketoimet, 18, 193-196.

