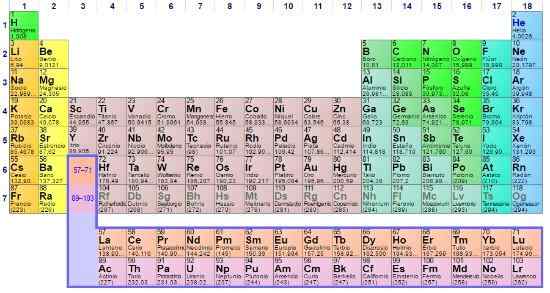
Määräaikaisen taulukon 8 merkitys
- 2644
- 646
- Sheldon Kuhn
Se Jaksollisen taulukon merkitys Hän on kiistaton yksinkertaisesta tosiasiasta. Se on eräänlainen rakennus, jossa on kokeellisia ja teoreettisia emäksiä, jotka tiivistävät tunnetun aineen ominaisuudet.
Vaikka useita malleja on kehitetty ennen venäläisen kemisti Dmitri Mendeleevin jaksollista taulukkoa, tarkoitus on aina ollut sama: järjestys, paikantaa ja ennusta kemiallisia elementtejä, joilla on yhteisiä ominaisuuksia. Siten tämän taulukon sijainnit tai laatikot paljastavat enemmän tietoa kuin voidaan haastatella paljaalla silmällä.
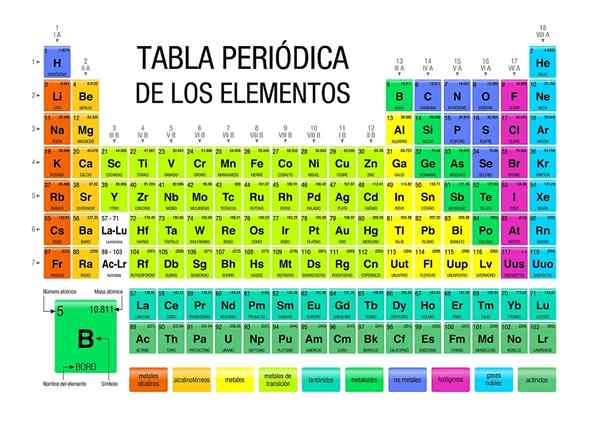 Määräaikaispöytä on kuvake ja tieteellinen työkalu, jossa kemia, fysiikka, historia ja kirjallisuus lähentyvät
Määräaikaispöytä on kuvake ja tieteellinen työkalu, jossa kemia, fysiikka, historia ja kirjallisuus lähentyvät Määräajoallinen taulukko on läsnä kaikilla akateemisen koulutuksen tasoilla, jopa yleisen tiedon kuvake. Vaikka se on välttämätöntä kemiassa, totuus on, että se on myös tärkeä fysiikassa ja biologiassa, sen lisäksi, että se on tutkimuksen lähde ja inspiraatio historian ja kirjallisuuden ystäville.
Siksi jotkut syyt, miksi jaksollinen taulukko on tärkeä.
Mikä on jaksollisen taulukon merkitys?
Voit antaa erilaisia syitä, jotka selittävät tämän tieteellisen työkalun merkityksen:
Se on epäorgaanisen kemian perusta

Epäorgaaninen kemia on käytännössä jaksollisen taulukon tutkimus. Ilman sitä kaikki tämän tyyppisen aineen ympärillä saavutetut tiedot tulevat alas. Ne, jotka ovat omistautuneet tälle kemian haaraan, on välttämätöntä, että he voivat lukea ja poimia kaikki tiedot, joita tämä taulukko tarjoaa, hiilen ja sen isotoopien ulkopuolella olevista kemiallisista elementeistä.
Orgaanisten kemikaalien kohdalla monta kertaa katsaus jaksollisen taulukon oikealta puolelta: tarkemmin lohkon yläosaa kohti p, missä hiili sijaitsee ja useita ei -metallia.
Voi palvella sinua: tritioToisaalta epäorgaanisten kemistien on tarkistettava kaikki lohkojen muodostavat metallit d -d ja F, samoin kuin jalokaasujen ryhmä 18, joten ne tutustuvat kaikkiin kemiallisiin elementteihin; paitsi ehkä ne, jotka ovat synteettisiä ja erittäin radioaktiivisia.
Valaista kemiallista tietoa
Ennen jaksollista taulukkoa ja ensimmäiset yritykset tilata kemialliset elementit sen samankaltaisuuksien perusteella, kemia käärittiin epävarmaan auraan ja mystiikkaan.
Kukaan ei tiennyt tarkalleen kuinka monta tai jotka olivat kaikki kemialliset elementit, jotka voisivat olla luonteeltaan. Tämän taulukon ansiosta tänään tiedetään, että meillä on enintään 118 elementtiä. Mikä näytti pimeältä aikaisemmin, nyt on selkeä, ymmärrettävä ja järjestetty.
Mahdollistaa uusien elementtien ominaisuuksien ennustamisen
Alussa jaksollisessa taulukossa oli tyhjiä tiloja, koska siihen mennessä useita kemiallisia elementtejä ei ollut löydetty.
Näiden tilojen sijainnit osoittivat, että uuden elementin, joka oli ikätovereidensa mukainen, piti reagoida samalla tavalla; Ja vielä enemmän, se löytyi jopa samoista mineraalilähteistä.
Ja se oli tosiasiassa mineraalisymfiinien kemiallisessa käsittelyssä, jossa puuttuvat kemialliset elementit löydettiin hitaasti; Esimerkiksi Gallium, Germanio ja Scandio. Galliumin, joka oli alumiinia, piti jakaa ominaisuuksia jälkimmäisen kanssa ja muodostaa mineraaleja (oksidit, sulfidit, kloridit jne.) sama tyyppi.
Jos elementti 119 luodaan, sen on välttämättä sijaitseva Francion alapuolella ryhmässä 1; ja siksi reagoi tai on kemiallisia ominaisuuksia, jotka ovat samanlaisia kuin muut alkaliset metallit (litium, natrium, kalium jne.-A.
Voi palvella sinua: laimennuskerroinEro ja luokittelee kemialliset elementit
Määräaikaisessa taulukossa on mahdollista tarkkailla, kuinka elementit luokitellaan ja saatavana tietyillä alueilla tai ryhmillä. Esimerkiksi ei -metallit ovat suunnattu oikealle yläkulmaan.
Samaan aikaan metallit, jotka muodostavat suurimman osan elementeistä, integroivat vasemman puolen ja pöydän keskustan sekä lohkon F: Nämä kaksi riviä alla.
Jokainen ryhmä on lueteltu välillä 1-18, määrittelee elementtiperheen. Ryhmän 1 jäseniä kutsutaan alkalisiksi metalleiksi, ryhmän 2, alkalinottimien metalleiksi, 3, skandion ryhmäksi ja niin edelleen. Joillakin ryhmillä on ainutlaatuisia nimiä, kuten ryhmä 16 tai happi, jota kutsutaan calcogeneiksi tai amfumoiksi.
Säilytä valtavia määriä tietoa
Jaksollisissa taulukoissa voimme nähdä kunkin elementin hapettumisnumerot, niiden ionisaatioenergiat, sen keskimääräinen atomimassa, sen elektroniset kokoonpanot, sen elektronegativiteetti ja koko sen jaksollisten ominaisuuksien joukko.
Joissakin taulukoissa on myös mahdollista löytää tietoa sen normaalista fuusio- ja kiehumispisteistä sekä kiinteiden aineiden kiteisistä rakenteista. Tässä mielessä esiintyy erikoistuneempia jaksollisia taulukoita kuin toiset, työstä ja akateemisesta tasosta riippuen.
Selventää jaksollisia suuntauksia
Jaksollisen taulukon ryhmien ja joukkojen jälkeen on mahdollista tarkkailla selkeästi, kuinka jaksolliset ominaisuudet muuttuvat siirtyessämme elementistä toiseen.
Esimerkiksi atomisäde vähenee koko rivin, vasemmalta oikealle, mutta kasvaa, kun ryhmän laskeutuminen. Myös metallinen merkki kasvaa ylhäältä alas ja oikealta vasemmalle.
Ennustaa muodostettujen yhdisteiden luonteen
Yhdisteet muodostuvat, kun kaksi tai useampi elementti reagoi toisiinsa. Riippuen heidän asemistaan jaksollisessa taulukossa, on mahdollista ennustaa, mikä tämän yhdisteen kemiallinen luonne on.
Voi palvella sinua: vetybromidi (HBR)Esimerkiksi, jos metalliset natrium- ja kaasukloorireaktiot, ne aiheuttavat natriumkloridia, suolaa. Tämä johtuu siitä, että natrium on metalli, kun taas kloori ei ole -metalli, jonka erot sen elektronegatiivisuuksien välillä ovat suuria, mikä suosii ionisen yhdisteen muodostumista.
Se on ikkuna tieteen historiaan
 Marie Curie
Marie Curie Jokaisella elementillä on historia ja löytäjät. Heidän pelkät nimensä ovat refleksejä tai niitä, jotka löysivät ne, maantieteellisiltä alueilta, joilla ne otettiin puhtaisiin muodoihinsa tai mineraaliensa ominaisväri. Esimerkiksi Helium Gas velkaa nimensä juuri siksi, että se tunnistettiin auringossa.
Määräaikaisessa taulukossa näemme pala Antoine Lavoisierin, Marie Curien, Carl Willhelm Scheelen, Henry Cavendishin, Paul Emile Lecogin ja monien muiden tutkijoiden, jotka osallistuivat pöydän loppuun saattaessaan uusia kemiallisia elementtejä, kun löydettäessä uusia kemiallisia elementtejä.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Helmestine, Anne Marie, PH.D -d. (11. helmikuuta 2020). Miksi ajanjakson taulukko on tärkeä? Toipunut: Admingco.com
- Ben p. Stein. (28. toukokuuta 2019). Määräajoin taulukko: Se on enemmän kuin vain kemia ja fysiikka. Toipunut: NIST.Hallitus
- Dennis Rouvray. (10. tammikuuta 2019). Aikataulukko oli kemian tärkein läpimurto. New Scientist Ltd. Toipunut: sanomalehden jäsen.com
- Wanda Thibodeaux. (26. huhtikuuta 2018). Jaksollisen taulukon merkitys. Toipunut: tiedekunnasta.com
- « Läpinäkymättömät objektit käsite, ominaisuudet ja esimerkit
- Live -ainekonsepti, ominaisuudet ja esimerkit »

