intialainen

- 2563
- 504
- Sheldon Kuhn
 Intialainen metallinen. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC by (https: // creativecommons.Org/lisenssit/by/3.0)]
Intialainen metallinen. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC by (https: // creativecommons.Org/lisenssit/by/3.0)] Mikä on intialainen?
Hän intialainen Se on metalli, joka kuuluu jaksollisen taulukon ryhmään 13 ja jolla on kemiallinen symboli. Atominumerosi on 49, 49Ja esitetään luonteeltaan kahtena isotooppina: 113Ja 115Jälkimmäinen on kaikkein runsas. Maapallolla intialaiset atomit löytyvät epäpuhtauksina sinkissä ja johtavissa mineraaleissa.
Se on erityinen metalli, koska se on pehmein, jota voidaan koskettaa ilman monia terveysriskejä; Toisin kuin litium ja rubidium, jotka polttaisivat ihon kauheasti reagoidessaan kosteuteensa. Pala intialainen voidaan leikata veitsellä ja murtumalla sormien voimalla, säteilemällä erottuvan rapistuksen.
Kuka tahansa tästä metallista kuulee, tulee varmasti mieleen Intiaa, mutta hänen nimensä on peräisin indigoväristä, jota havaitaan, kun liekin testi suoritetaan. Tässä mielessä se näyttää melko paljon kaliumia, polttaen metallinsa tai sen yhdisteet erittäin tyypillisellä liekillä, jonka läpi intialainen havaittiin ensimmäistä kertaa Sphenset -mineraaleissa.
Intialaiset jakavat monia kemiallisia ominaisuuksia alumiinin ja galliumin kanssa, esittäen useimmissa yhdisteissä, joiden hapettumismäärä +3 (in3+-A. Se yhdistyy erinomaisesti Gaulin muodostavien seoksien kanssa, joilla on matala sulamispiste, yksi niistä on Galinstan.
Intialaiset sovellukset perustuvat Materiaalien vuoraukseen heidän seoksillaan, mikä tekee niistä sähköisiä ja joustavia johtimia. Intialaisella on lasia myöntää heille suurempia kimalteita, korvaamalla hopea. Teknologiamaailmassa intialainen löytyy kosketusnäytöistä ja LCD: ltä.
Löytö
Vuonna 1863 saksalainen kemisti Ferdinand Reich etsi Talio -elementin jälkiä, käyttämällä sen emissiospektrin vihreää viivaa Cinc -mineraaleissa; Erityisesti näytteet sphaleriitista (Zns) Saksin ympärillä. Mineraalien paahtamisen jälkeen poista niiden rikkipitoisuus, sulaa ne suolahapossa ja tislata sinkkikloridi, sai pajizon saostuman.
Löytön perusteella Reich päätti suorittaa spektroskooppisen analyysin; Mutta koska hänellä ei ollut hyviä silmiä tarkkailemaan värejä, hän meni kollegansa Hariomus Theodor Richterin luo auttamaan häntä tässä tehtävässä. Richter oli se, joka havaitsi sinertävän spektrin linjan, joka ei vastannut minkään muun elementin spektriä.
Se voi palvella sinua: jodoosihappo (HIO2): Ominaisuudet ja käytötKaksi saksalaista kemistiä oli edessään uutta elementtiä, jota kutsuttiin intialaiseksi väriksi liekin indigonväriksi, kun niiden yhdisteet poltettiin; Ja puolestaan tämän värin nimi johtuu latinalaisesta sanasta Indikaattori, Mitä Intia tarkoittaa.
Vuotta myöhemmin, vuonna 1864, innostuneita ja pitkäaikaisen sadesarjan ja puhdistussarjan jälkeen he eristivät näytteen metallisesta intialaisesta.
Intialainen rakenne
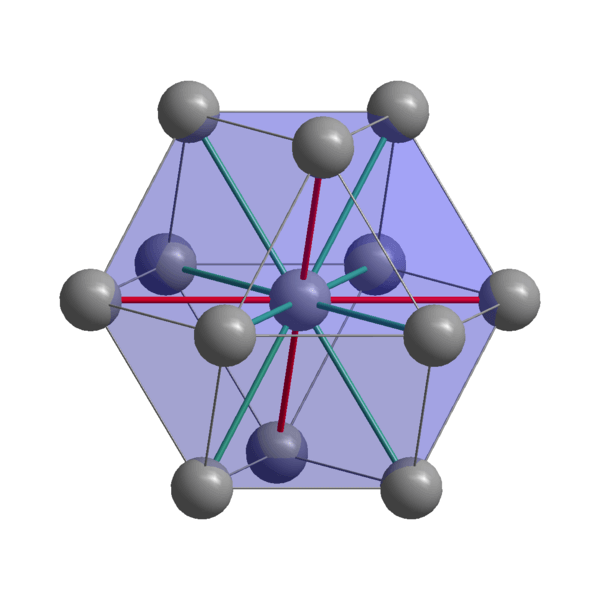 Intialainen kiteinen rakenne
Intialainen kiteinen rakenne Intialainen, koheesio -atomit käyttämällä niiden valenssielektroneja metallisidoksen luomiseksi. Siten ne lopulta tilataan vääristyneeseen tetragonaalirakenteeseen, joka on keskitetty runkoon. Vuorovaikutukset In-In-Naaghbor-atomien välillä on suhteellisen heikko, mikä selittää miksi intialaisella on matala sulamispiste (156 ºC).
Toisaalta kaksi tai useampia intialaisia kiteitä yhdistävät voimat eivät myöskään ole vahvoja, muuten ne eivät liiku toistensa päällä, antaen metallin ominaisen pehmeyden.
Intialaiset kiinteistöt
Fyysinen ulkonäkö
Se on huomattavan pehmeä hopeametalli. Se voi repiä kynsien paineen kanssa, leikata veitsellä tai naarmuttaa kirkkaissa iskuissa paperiarkilla. Se on jopa mahdollista pureskella ja muodostuu se hampailla, jos se on litistetty. Se on myös erittäin taipuisa ja muokattavissa, sillä on muoviset ominaisuudet.
Kun taskulamppu lämmitetty intialainen hylkää indigonvärin liekin, vielä kirkkaampi ja värikkämpi kuin kaliumin.
Moolimassa
114,81 g/mol
Sulamispiste
156,60 ºC
Kiehumispiste
2072 ºC.
Gaulin tavoin intialaisella on suuri lämpötilaväli fuusiopisteen ja kiehumisen välillä. Tämä heijastaa sitä tosiasiaa, että in-in-in-vuorovaikutukset nesteessä ovat voimakkaampia kuin lasissa vallitsevat; Ja siksi on helpompaa saada tippa intialaista kuin heidän höyrynsä.
 Intialainen sijainti jaksollisessa taulukossa. Lähde: Daniel Mayer tai GreatPatton Vektorisointi: Sushant Savla, CC BY-SA 3.0, Wikimedia Commons
Intialainen sijainti jaksollisessa taulukossa. Lähde: Daniel Mayer tai GreatPatton Vektorisointi: Sushant Savla, CC BY-SA 3.0, Wikimedia Commons Tiheys
Huoneenlämpötilassa: 7,31 g/cm3
Aivan sulamispisteessä: 7,02 g/cm3
Elektronegatiivisuus
1.78 Pauling -asteikolla
Ionisaatioenergiat
Ensimmäinen: 558,3 kJ/mol
Toinen: 1820,7 kJ/mol
Kolmas: 2704 kJ/mol
Lämmönjohtokyky
81,8 W/(M · K)
Sähkövastus
83,7 nω · m
Mohsin kovuus
1.2. Se on tuskin hiukan kovempi kuin talkki (ei hämmentävä sitkeys).
Reaktiivisuus
Intialaiset liukenee happoihin aiheuttamaan suoloja, mutta ei liukene alkalisiin liuoksiin, jopa kuumalla kaliumhydroksidilla. Reagoi suoraan kosketuksessa rikin, hapen ja halogeenien kanssa.
Voi palvella sinua: laimennus: käsite, miten se tehdään, esimerkkejä, harjoituksiaIntialainen on suhteellisen amfoteerinen, mutta käyttäytyy enemmän perustana kuin happona, koska se on sen hieman emäksisiä vesiliuoksia. In (OH)3 Se uudelleen on lisätty lisää alkalia aiheuttavia indiete -komplekseja, kohdassa (OH)4-, Kuten alumiinioksissa.
Elektroninen kokoonpano
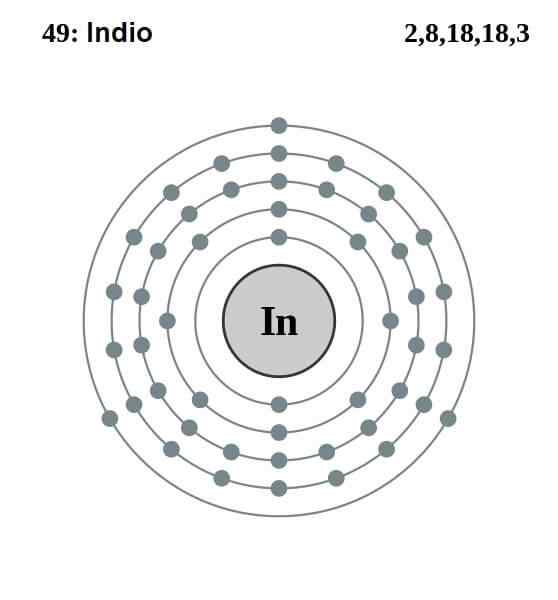 Intialainen sähköinen kokoonpano
Intialainen sähköinen kokoonpano Intian sähköinen kokoonpano on seuraava:
[KR] 4d10 5s2 5 p1
Niistä kolmestatoista elektronista kolme viimeistä 5: n ja 5p: n kiertoradalla ovat Valencia. Näillä kolmella elektronilla intialaiset atomit muodostavat metallisidoksensa, kuten alumiini ja gallium, ja muodostavat kovalenttisia sidoksia muiden atomien kanssa.
Hapetusluvut
Edellä mainittua käytetään kerralla, että intialainen pystyy menettämään kolme Valencia -elektroniaan tai voittamaan viisi tullakseen isolektroniseksi jalolle kaasu ksenonille.
Jos yhdisteessä oletamme, että se on menettänyt kolme elektroniaan, se pysyy kolmiuloisena kationina3+ (Analogiassa Al3+ ja GA3+) Ja siksi hapettumisnumerosi on +3. Useimmat intialaiset yhdisteet ovat kohdassa (iii).
Intialaiselta löydettyjen hapettumisnumeroiden joukossa on: -5 (5-), -2 (sisään2-), -1 (sisään-), +1 (sisään+) ja +2 (sisään2+-A.
Joitakin esimerkkejä yhdisteistä (i) ovat: inf, sis., Inbr, ini ja sisään2JOMPIKUMPI. Kaikki ne ovat suhteellisen harvinaisia yhdisteitä, kun taas in (iii) ovat hallitsevia: in (OH)3, Sisään2JOMPIKUMPI3, Kattaa3, Inf3, jne.
(I) yhdisteet ovat voimakkaita pelkistäviä aineita, joissa+ lahjoita kaksi elektronia muille lajeille tullaksesi sisään3+.
Isotoopit
Intialainen esitetään luonteeltaan kahtena isotooppina: 113Ja 115, Joiden maa -alueet ovat vastaavasti 4,28% ja 95,72%. Siksi maan päällä meillä on paljon enemmän atomeja 115Siinä 113Sisään. Hän 115IN: n puoli -elämä on 4,41 · 1014 vuosia, niin hienoa, että sitä käytännössä pidetään vakaana, huolimatta siitä, että se on radioisotooppi.
Tällä hetkellä on luotu yhteensä 37 intialaisen, radioaktiivisen ja erittäin epävakaan keinotekoista isotooppia. Kaikista heistä on vakain 111In, jonka puoli -elämä on 2,8 päivää.
Käyttää/sovelluksia
Seokset
Intialainen tulee hyvin toimeen galliumin kanssa. Molemmat metallit muodostavat seoksia, jotka Mel. Lisäksi intialainen on myös helposti yhdistelmä, sillä se on 57% liukoisuus elohopeaan.
Voi palvella sinua: etikkahappo (CH3COOH)Intialaisia seoksia käytetään hopeapeilien suunnitteluun ilman hopeaa. Kun ne kaadetaan minkä tahansa materiaalin alueelle, se toimii tarttuvana, jotta lasi, metalli, kvartsi ja keramiikka voidaan kerätä.
elektroniikka
 Ilman intialaista kosketusnäyttöjä ei olisi koskaan ollut olemassa
Ilman intialaista kosketusnäyttöjä ei olisi koskaan ollut olemassa Intialainen tulee myös Germanion kanssa, joten hänen yhdisteet lisätään seoksena LEDien germaaniseen nitruroon, toistaen nämä seokset siniset valot, violetti ja vihreä. Se on myös osa transistoreja, termistoreita ja aurinkosähkökennoja.
Tärkein yhdisteistä on tina- ja intialainen oksidi, jota käytetään lasivuorina joidenkin aallonpituuksien heijastamiseen. Tämän avulla voit käyttää hitsauslasien ja naarmulasissa, jotta ne eivät lämmitä sisällä.
Tällä oksidilla päällystetyt lasi ovat hyviä sähköjohtimia; Kuin sormemme. Ja siksi se on tarkoitettu kosketusnäyttöjen valmistukseen, mikä on vielä enemmän nykyistä toimintaa johtuen yhä enemmän älypuhelimista.
Riskejä
 Intialainen kiinteä osavaltiossa. Lähde: W. Oelen, cc by-sa 3.0, Wikimedia Commons
Intialainen kiinteä osavaltiossa. Lähde: W. Oelen, cc by-sa 3.0, Wikimedia Commons Intialainen ei ensinnäkin ole mitään riskiä ympäristölle, kuten sen ioneissa3+ Niitä ei levitetä huomattavina määrinä. Ei ole tietoa siitä, mitkä sen vaikutukset maaperään olisivat, vaikuttavat kasveihin, eikä eläimistöllä tai merillä.
Kehossa ei tiedetä, ionit3+ Heillä on jonkin verran olennaista osallistumista aineenvaihduntaan jälkiä. Kuitenkin, kun niiden yhdisteet nautitaan, ne ovat haitallisia useille elimille, minkä vuoksi niitä pidetään erittäin myrkyllisinä aineina.
Itse asiassa ITO -hiukkaset (tina- ja intialainen oksidi, sen lyhenne englanniksi: Indium -tinioksidi;.
Näiden hiukkasten saanti tapahtuu ennen kaikkea hengittämällä ja kosketuksella ihon ja silmien läpi.
Toisaalta hienot metalliset intialaiset hiukkaset ovat alttiita polttamaan ja aiheuttavat tulipaloja, jos ne ovat aidat lämmönlähde.

