Immunofluoresenssisäätiö, protokolla ja sovellukset
- 2513
- 443
- Joshua Emmerich
Se immunofluoresenssi Se on tehokas immunomarcy -tekniikka, joka käyttää vasta -aineita yhdistyneinä kovalenttisesti fluoresoiviin molekyyleihin tunnistaakseen spesifiset kohteet solujen näytteissä kiinnitettynä kiinteään tukeen.
Tämä tekniikan mikroskooppinen havainto immuunispesifisyydellä, mikä mahdollistaa elävien tai kuolleiden solujen havainnot, joilla voi olla pieniä määriä antigeenejä. Sitä käytetään laajasti sekä tutkimuksen alalla että erilaisten patologioiden kliinisessä diagnoosissa.
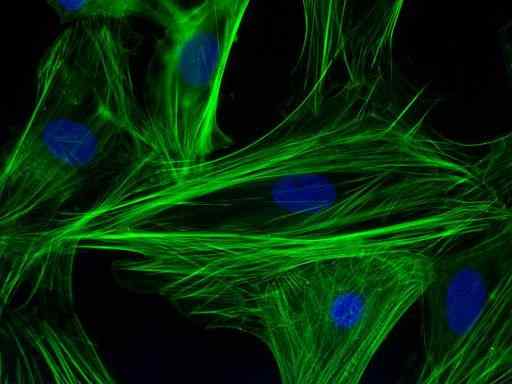
 Aktiinifilamenttien immunomarness kardiomyosyyttisoluissa (lähde: PS1415 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Aktiinifilamenttien immunomarness kardiomyosyyttisoluissa (lähde: PS1415 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Tämä pääasiassa laadullinen tekniikka (joillakin kvantitatiivisilla variantteilla) on tehtävä erityisesti näytteen visualisoinnilla fluoroforin tuotteen avulla, joka on vasta -aineeseen kiinnitetty fluoresoiva molekyyli ja joka kykenee kiinnostamaan itseään tietyllä aallonpituudella.
Soluyhteydessä on erittäin hyödyllistä tutkia proteiinien läsnäolo/puuttuminen ja solunsisäinen sijainti. Tekniikkaa käytettiin sen alussa kliinisellä kentällä virusten, kuten influenssan diagnosoinnissa, ja myöhemmin monien muiden tartuntatautien kohdalla.
Se on erittäin herkkyyden tekniikka, ja oikean mikroskopiatiimin kanssa sillä voi olla erittäin hyvä resoluutio. Se vaatii havainnoistaan konfokaalisten tai epifluoresenssimikroskooppien käyttöä.
Huolimatta siitä, että olet erittäin suosittu, voit kuitenkin aiheuttaa joitain tärkeitä ongelmia epäspesifisen fluoresenssin saamiseksi, joka tuottaa tietyn "melun" taustalla, mikä usein rajoittaa tulosten oikeaa lukemista.
[TOC]
Perusta
Immunofluoresenssi perustuu vasta -aineen ja antigeenin välisen vuorovaikutusreaktion biologisen ilmiön hyödyntämiseen. Sen on tehtävä erityisesti tämän reaktion visualisoinnin tai havaitsemisen kanssa, kun jännittäviä fluoresoivia molekyylejä tietyllä aallonpituudella.
Vasta -aine on aktiivisista B -soluista eritelty immunoglobuliiniproteiini, ja se syntyy spesifisesti antigeeniä vastaan, joka voidaan yhdistää suurella affiniteettilla ja spesifisyydellä. Immunofluoresenssi käyttää IgG -immunoglobuliineja, joita havaitaan liukoisesti veren seerumissa.
Vasta -aineet ovat molekyylejä, jotka ovat jopa 950 kDa, jotka koostuvat kahdesta lyhyestä peptidistä (valo) ja kahdesta pituudesta "y": n muodossa (raskas). Sekä kevyt että raskaat ketjut on jaettu kahteen domeeniin: yksi muuttuja, joka kykenee tunnistamaan antigeenin ja toinen vakio tai säilytetty.
Antigeenit määritellään toiminnallisesti molekyyleiksi, jotka voidaan tunnistaa vasta -aineella ja jotka ovat enimmäkseen proteiineja. Kun eläin altistuu antigeenille, immuunijärjestelmän lymfosyytit aktivoidaan, tuottaen spesifisiä vasta -aineita sitä vastaan ja toimivat puolustusjärjestelmänä.
Esimerkiksi antigeenillä, kuten proteiinilla, voi olla useampi kuin yksi epitooppi tai tunnistuspaikka vasta -aineelle, joten antigeenille altistetun eläimen seerumilla voi olla polyklonaalisia vasta -aineita saman proteiinin eri alueita vastaan.
Se voi palvella sinua: sipulin orvaskeusImmunofluoresenssi hyödyntää sitten eläimen kykyä tuottaa polyklonaalisia vasta -aineita spesifistä antigeeniä.
Joidenkin immunofluoresenssitekniikoiden eniten käytettyjä fluoresoivia väriaineita tai molekyylejä ovat fluoreseiini-isootiosyanaatti (FITC), tetrametyylirodamiini-5 ja 6 (tritc) isochianaatti, monet syaanit, kuten Cy2, Cy3, Cy5 ja Cy7 ja Dyes, nimeltään Alexa Fluor®, kuten Alexa Fluor®448.
Protokolla
Immunofluoresenssiprotokolla vaihtelee riippuen monista tekijöistä, mutta yleensä kattaa lineaarisen vaiheen sekvenssin, joka koostuu:
- Arkkien ja solujen valmistelu
- Näytteen kiinnitys
- Läpäisy
- Esto
- Immunotive tai immunomarcaje
- Kokoonpano ja havainto
-Valmistautuminen
Näytteistä
Näytteiden valmistelu riippuu niiden luonteesta ja suoritettavasta kokemuksesta. Seuraavaksi selitetään yksinkertaisin tapaus, mikä merkitsee suspendoitujen solujen käyttöä.
Suspensiosolut, toisin sanoen nestemäisessä viljelyalustassa, on ensin erotettava tästä sentrifugoimalla ja on sitten pestään puskuriliuoksella tai ”puskuri" isosmoottinen, joka säilyttää sen eheyden.
Normaalisti fosfaatti-Saline-puskuria tunnetaan nimellä PBS, jossa solut suspendoivat uudelleen.
Arkkien
Mikroskooppiseen havaintoon käytetyt levyt, joissa solut asetetaan vastaaville alavirran käsittelyille, on myös valmistettava huolellisesti.
Nämä ovat peitetty tai "herkistetty" polysiiniliuoksella, synteettisellä polymeerillä, joka toimii "molekyyliliimana" solujen välillä ja kiinteän tuen välisen kiinteän tuen ansiosta niiden aminoryhmien positiivisten varausten ja peittävien negatiivisten proteiinien positiivisten varausten välillä, jotka peittävät negatiiviset kuormat, jotka peittävät negatiiviset proteiinit solut.
Näytteen kiinnitys
Tämä prosessi koostuu solujen sisätiloissa olevien proteiinien immobilisoinnista, jotta niiden alueellinen sijainti on ehjänä. Käytettyjen molekyylien tulisi pystyä ylittämään kaikenlaiset solukalvot ja muodostamaan kehykset kovalenttisilla proteiineilla.
Formaldehydi ja paraformaldehydi, glutaraldehydi ja jopa metanolia käytetään laajasti, joiden kanssa solunäytteitä inkuboitiin tiettyyn aikaan ja pese ne sitten isosmoottisella puskuriliuoksella.
Solujen kiinnittymisen jälkeen se jatkaa niihin liittymistä aiemmin herkistetyille levyille polysiinilla.
Läpäisy
Suoritetun testin tyypistä riippuen on tarpeen, että tutkittavissa olevat solut ovat permeabilisoida tai ei. Jos etsitään tietyn proteiinin sijainti, läsnäolo tai poissaolo solun pinnalla, läpäisy ei ole tarpeen.
Voi palvella sinua: fosfatidyylinositoli: rakenne, harjoittelu, toiminnotToisaalta, jos haluat tietää proteiinin sijainnin solujen sisäosassa, läpäiseminen on välttämätöntä ja koostuu inkubointinäytteistä Triton X-100: n kanssa, pesuaine, joka pystyy läpäisemään solumembraanit,.
Esto
Kaikissa immunologisissa tekniikoissa on estävä perustavanlaatuinen askel. Menetelmän tässä vaiheessa saarto koostuu peittosta, herkistetyissä arkeissa, kaikki kohdat, joissa on polyesiinimolekyylejä, joita soluja ei kiinnittynyt. Eli se estää kaikki epäspesifiset liitto.
Normaalisti PBS -puskurissa käytetään ratkaisuja, joilla on hera -naudan albumiinialue (BSA), ja parhaat tulokset saadaan, sitä pidempään on inkubaatioaika tämän ratkaisun kanssa. Jokaisen askeleen jälkeen, salpaus mukaan lukien, on välttämätöntä poistaa jäljellä oleva liuos pesemällä.
Immunotive tai immunomarcaje
Immunomarian tai immunomarianusmenettely riippuu pääasiassa, jos se on suora tai epäsuora immunofluoresenssi (katso myöhemmin).
Jos se on ensisijainen tai suora immunofluoresenssi, näytteitä inkuboidaan haluttujen vasta -aineiden kanssa, jotka on kytketty fluoresoiviin väriaineisiin. Inkubaatiomenettely koostuu vasta -aineen laimentamisesta liuoksessa, jota myös BSA sisältää, mutta alhaisemmassa osassa.
Kun tapaus on toissijainen tai epäsuora immunofluoresenssi, on tehtävä kaksi peräkkäistä inkubaatiota. Ensin haluttujen vasta -aineiden ja sitten vasta -aineiden kanssa, jotka kykenevät havaitsemaan primaaristen immunoglobuliinien vakioalueet. Juuri nämä sekundaariset vasta -aineet yhdistyvät kovalenttisesti fluoroforeihin.
Tekniikka on erittäin monipuolinen, mikä mahdollistaa useamman kuin yhden antigeenin samanaikaiset merkit näytettä kohti, kunhan niillä on primaarisia vasta -aineita kytkettynä erilaisiin fluoroforeihin, suoran immunofluoresenssin tapauksessa.
Epäsuorassa immunofluoresenssissa samanaikaisissa merkinnöissä se on välttämätöntä.
Kuten saarto, inkubointi vasta -aineiden kanssa antaa parempia tuloksia, mitä suurempi on tämän ajan. Jokaisen vaiheen jälkeen on tarpeen pestä ylimääräiset vasta -aineet, jotka eivät liity näytteisiin, ja sekundaarisessa immunofluoresenssissa on tarpeen estää ennen sekundaarisen vasta -aineen lisäämistä.
Tietyissä tekniikoissa käytetään muita väriaineita, joilla ei ole mitään tekemistä immunomarian kanssa, kuten ydin -DNA: n värjäytyminen DAPI -fluoroforilla.
Kokoonpano ja havainto
Lopullisen inkubaatioajan aikana fluoroforien kanssa on välttämätöntä, että näytteet pysyvät pimeässä. Mikroskoopin havainnoissa se on yleistä.
Kaverit
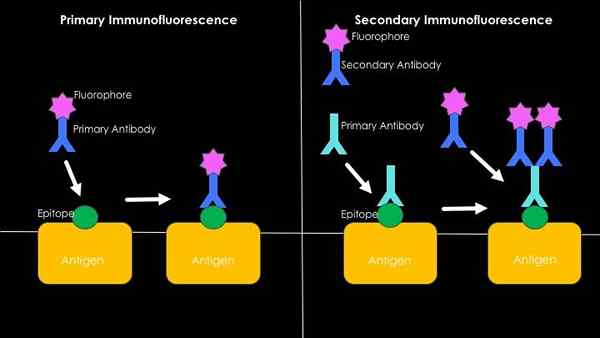 Graafinen yhteenveto suorasta ja epäsuorasta immunofluoresenssista (lähde: Westhayl618 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Graafinen yhteenveto suorasta ja epäsuorasta immunofluoresenssista (lähde: Westhayl618 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Suora tai ensisijainen immunofluoresenssi
Se liittyy antigeenien havaitsemiseen fluoresoivien vasta -aineiden avulla. Tämän tekniikan käytön tärkein etu on sen nopeus, mutta prosessissa voi kuitenkin tapahtua monia epäspesifistä unionia, etenkin kun tutkitaan ihmisen seerumia, koska ne ovat runsaasti hyvin heterogeenisiä vasta -aineita.
Voi palvella sinua: tärkeimmän bioteknologian 5 haaraaEpäsuora tai sekundaarinen immunofluoresenssi
Se tunnetaan myös nimellä “voileipä” tekniikka ja tämä tarkoittaa tekniikan kehittämistä kahdessa vaiheessa. Ensimmäinen liittyy ei -fluoresoivan vasta -aineen ja sen liiton käytön kanssa kiinnostuksen kohteena olevaan antigeeniin.
Tämän ensimmäisen vasta -aineen jatkuvaa aluetta vastaan (joka toimii nyt antigeeninä) toinen vasta -aine, joka kykenee tunnistamaan sitä, mikä liittyy fluoresoivaan molekyyliin.
Fluoresoivan signaalin esiintyminen on tulosta erityisestä tunnistuksesta ensimmäisen ei -fluoresoivan vasta -aineen ja kiinnostavan antigeenin välillä; Tämän toisen vasta -aineolosuhteen läsnäolo toisen, joka on merkitty, ja jonka antigeenin esiintyminen tai puuttuminen voidaan määrittää.
Huolimatta siitä, että se on tekniikka, joka kuluttaa paljon pidempään kuin suora immunofluoresenssi (koska se sisältää enemmän inkubaatiovaihetta), tämä tekniikka ei tarkoita fluoresoivan vasta -aineen suunnittelua jokaiselle tutkittavalle antigeenille, mikä johtaa taloudellisesti elinkelpoisemmin.
Lisäksi se on herkempi tekniikka signaalin monistumisen suhteen, koska useampi kuin yksi sekundaarinen vasta -aine voi liittyä primaarisen vasta -aineen vakioalueeseen, mikä monistaa fluoresoivan signaalin voimakkuutta.
Sovellukset
Kuten aiemmin havaittiin, immunofluoresenssi on erittäin monipuolinen tekniikka, johon on annettu käyttötarkoituksen moninaisuuden ja kliinisen alan monimuotoisuus. Sitä voidaan käyttää vastaamaan ekologisiin, geneettisiin ja fysiologisiin kysymyksiin monista organismeista.
Kliinisten sovellusten joukossa sitä käytetään joidenkin dermatologisten sairauksien suoran diagnoosiin riippumatta.
Immunofluoresenssitekniikat on järjestetty yksisoluisiin organismeihin, kuten hiivoihin, jotta voidaan visualisoida intranukleaariset ja sytoplasmiset mikrotubulukset, aktiinit ja niihin liittyvät proteiinit, 10 nm filamentit ja muut sytoplasman, kalvo- ja soluseinämien aineosat, kalvot ja soluseinät.
Viitteet
- Abcam, immunosytokemia ja immunofluoresenssiprotokolla. Abcamista haettu.com
- Greph, c. (2012). Fluoresoivat väriaineet. Haettu Leica-Microsystems.com
- Miller, D. M., & Shakest, D. C. (tuhatyhdeksänsataayhdeksänkymmentäviisi). Immunofluoresenssimikroskopia. Sisään Menetelmät solubiologiassa (Vol. 48, s. 365-394). Academic Press, Inc.
- Odell, I. D -d., & Kokki, D. (2013). Immunofluoresenssitekniikat. Journal of Investrative Dermatology, 133, 1-4.
- Prinssi, b. J -. R -., Adams, a. JA. M., Druain, D. G., & Brian, K. (1991). Hiivien immunofluoresenssimenetelmät. Sisään Entsymologian menetelmät (Vol. 194, s. 565-602). Academic Press, Inc.
- Schaeffer, M., Orsi, e. V, & Widelock, D. (1964). Immunoflorenssin sovellukset kansanterveysvirologiassa. Bakteriologiset arvostelut, 28(4), 402-408.
- E. G., & Anderson, D. M. (1996). Immunofluoresenssi kasviplanktonin tutkimuksessa: sovellukset ja potentiaali. J: Phycol., 32, 1-16.
- « Areolaarinen nopeus miten se lasketaan ja ratkaistaan harjoituksia
- Alberto Fujimorin hallitus ensimmäinen ja toinen hallitus »

