Hydrofobiset vuorovaikutukset Mikä on, merkitys, esimerkkejä
- 2754
- 328
- Gabriel Fahey
Se Hydrofobiset vuorovaikutukset (HI) Ne ovat voimia, jotka ylläpitävät koheesiota apolaaristen yhdisteiden välillä upotettuna polaariseen liuokseen tai liuottimeen. Toisin kuin muut ei-kovalenttiset vuorovaikutukset, kuten vety sillat, ioniset vuorovaikutukset tai van der waals -voimat, hydrofobiset vuorovaikutukset eivät riipu liuenneiden aineiden luontaisista ominaisuuksista, vaan pikemminkin liuottimista.
Erittäin havainnollistava esimerkki näistä vuorovaikutuksista voi olla vaiheen erottelu, joka tapahtuu veden sekoittamisen kanssa öljyn kanssa. Tässä tapauksessa öljymolekyylit "ovat vuorovaikutuksessa" toistensa kanssa niiden ympärillä olevien vesimolekyylien tilaamisen seurauksena.
 Rasvan emulsio vedessä (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons)
Rasvan emulsio vedessä (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons) Näiden vuorovaikutusten käsite on olemassa ennen 40 -vuotiaita. Kauzmann kuitenkin keksi termin "hydrofobinen linkki" vuonna 1959, kun tutkittiin tärkeimpiä tekijöitä tiettyjen proteiinien kolmenulotteisen rakenteen stabiloinnissa.
Hänen ovat tärkeimmät epäspesifiset vuorovaikutukset, jotka tapahtuvat biologisissa järjestelmissä. Heillä on myös tärkeä rooli monissa tekniikan sovelluksissa sekä tänään tunnetuissa kemiallisissa ja lääketeollisuudessa.
Hydrofobisten vuorovaikutusten syy
Hänen fysikaalinen syy perustuu apolaaristen aineiden kyvyttömyyteen muodostaa vety sidoksia vesimolekyylien kanssa liuoksessa.
Niitä kutsutaan "epäspesifisiksi vuorovaikutuksiksi", koska ne eivät liity liuenneen aineen molekyylien väliseen affiniteettiin, vaan pikemminkin vesimolekyylien taipumukseen ylläpitää omia vuorovaikutuksiaan vety sidosten avulla.
Voi palvella sinua: biosurfaktantitKosketuksessa veden kanssa apolaariset tai hydrofobiset molekyylit yleensä lisäävät spontaanisti suuremman stabiilisuuden saavuttamiseksi vähentämällä kosketuspinnan aluetta vedellä.
Tämä vaikutus voitaisiin sekoittaa voimakkaaseen vetovoimaan, mutta se ei ole muuta kuin seurausta aineiden apolaarisesta luonteesta suhteessa liuottimeen.
Termodynaamisesta näkökulmasta selitetyt spontaanit assosiaatiot tapahtuvat energisesti suotuisan tilan etsimisessä, jossa sinulla on vähiten vapaa energian vaihtelu (∆G-A.
Ottaen huomioon sen ∆G = ∆H - T∆S, Entropia on energisesti suotuisin tila (∆S) Ole suurempi, toisin sanoen, jos vesimolekyylejä on vähemmän.
Kun apolaariset molekyylit liittyvät toisiinsa, vesimolekyylien pakottamat, saadaan suotuisampi tila kuin jos nämä molekyylit pysyisivät erillään, kumpikin ympäröi eri vesimolekyylien "häkki".
Biologinen merkitys
Hänen on suuri merkitys, koska niitä esiintyy biokemiallisten prosessien monimuotoisuudessa.
Näiden prosessien joukossa ovat proteiinien konformaatiomuutokset, entsyymisubstraattien liitto, entsymaattisten kompleksien alayksiköiden assosiaatio, biologisten kalvojen aggregaatio ja muodostuminen, proteiinien stabilointi vesipitoisissa liuoksissa ja muissa.
Kvantitatiivisesti eri kirjoittajat ovat antaneet tehtävän määrittää, mikä hänen merkitys on suurten proteiinien rakenteen stabiilisuudessa, päättelee, että nämä vuorovaikutukset vaikuttavat yli 50 %.
Se voi palvella sinua: oksidaasiglukoosi: Ominaisuudet, rakenne, toiminnotMonet membraaniproteiinit (integraali ja perifeeriset) liittyvät lipidikaksoiskerroksiin HI: n ansiosta, kun niiden rakenteissa näillä proteiineilla on hydrofobisia domeeneja. Lisäksi monien liukoisten proteiinien tertiäärisen rakenteen stabiilisuus riippuu HI: stä.
Jotkut solusbiologian tutkimuksen tekniikat hyödyntävät ominaisuutta, jonka jotkut ioniset pesuaineet POS.
Mislejä käytetään myös farmaseuttisissa tutkimuksissa, joihin sisältyy rasva -liukenevien lääkkeiden toimittaminen, ja niiden muodostuminen on välttämätöntä myös monimutkaisten vitamiinien ja lipidien imeytymiselle ihmiskehossa.
Esimerkkejä hydrofobisista vuorovaikutuksista
Kalvot
Erinomainen esimerkki HI: stä on solukalvojen muodostuminen. Tällaiset rakenteet koostuvat fosfolipidien kaksikerroksisesta. Organisaatiosi annetaan hänen ansiosta, joka tapahtuu apolaaristen pyrstöjen välillä "torjunnassa" ympäröivään vesipitoiseen ympäristöön.
Proteiinit
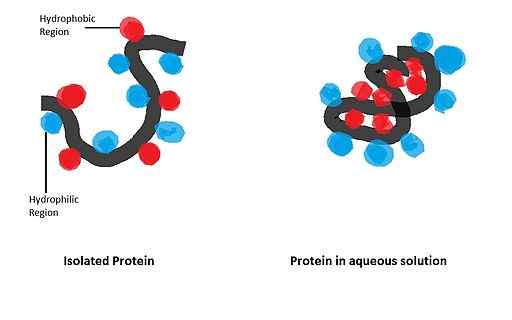
Hänellä on suuri vaikutus globaalien proteiinien laskostumiseen, joiden biologisesti aktiivinen muoto saadaan tietyn alueellisen kokoonpanon muodostumisen jälkeen, jota säätelee tiettyjen aminohappojätteen läsnäolo rakenteessa.
- Apomioglobiinin tapaus
Apomikoglobiini (myoglobiinia, josta puuttuu Hemo-ryhmä) on pieni alfa-helikoidinen proteiini, joka on toiminut mallina taittamisprosessin tutkimiseksi ja hänen apolaarisen jätteidensä tärkeydestä samassa polypeptidiketjussa.
Dysonin ja yhteistyökumppaneiden tekemässä vuonna 2006 tekemässä tutkimuksessa, jossa käytettiin apomioglobiinin mutatoituneita sekvenssejä, osoitettiin, että tämän taittumisen tapahtumien aloittaminen riippuu ensisijaisesti hänen aminohappojen joukosta alfa-helisien apolaaristen ryhmien kanssa.
Se voi palvella sinua: Aineen ja energian välinen suhde, jota havaitaan solujen ravinnossaSiten aminohapposekvenssissä tehdyt pienet muutokset keskimääräiset tärkeät modifikaatiot tertiäärisessä rakenteessa, mikä johtaa huonosti muodostuviin ja inaktiivisiin proteiineihin.
Pesuaineet
Toinen selkeä esimerkki hänestä on kaupallisten pesuaineiden toimintatapa, jota käytämme joka päivä kotimaan tarkoituksiin.
Pesuaineet ovat amfaattisia molekyylejä (polaarisella alueella ja toinen apolaarinen). Ne voivat "emulgoida" rasvaa, koska heillä on kyky muodostaa vety sidoksia vesimolekyyleihin ja heillä on hydrofobisia vuorovaikutuksia rasvoissa olevien lipidien kanssa.
Kun se on kosketettu rasvan kanssa vesiliuokseen, pesuaineen molekyylit liittyvät toisiinsa siten, että apolaariset pyrstöt pinnat, lipidimolekyylit ja ovat altistuneet Mycelan pinnalle polaariset alueet, jotka tulevat vesikosketukseen.
Viitteet
- Chandler, D. (2005). Rajapinnat ja hydrofobisen kokoonpanon käyttövoima. Luonto, 437(7059), 640-647.
- Dyson, J. H., Wright, P. JA., & Sheraga, H. -Lla. (2006). Hydrofobisten vuorovaikutusten rooli proteiinien laskostumisen aloittamisessa ja leviämisessä. PNA: t, 103(35), 13057-13061.

