Isopentano -rakenne, ominaisuudet, käytöt, hankkiminen
- 1127
- 100
- Arthur Terry II
Hän Isopentano Se on orgaaninen yhdiste, jonka tiivistetty kaava on (CH3-A2Shakki2CH3. Se on alkaani, erityisesti Pentanin haarautunut isomeeri, jolle on ominaista erittäin haihtuva neste ja käyttää kuohuviini -aineena. Tällä hetkellä IUPAC: n suositusnimi on 2-metyylibutaani.
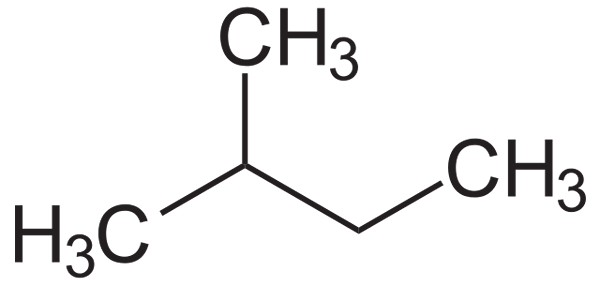
Alemmassa kuvassa sen rakennekaava voidaan nähdä. Huomaa, että ryhmä ch3 Tehokkaasti se liittyy butyyliketjun hiili 2. Isopentanosta saadaan isopentil- tai isopentil -radikaali, koska se on yksi suurimmista alquilical -substituenteista, jotka voivat olla.
 Isopentanon rakennekaava. Lähde: Neurotoger / julkinen alue
Isopentanon rakennekaava. Lähde: Neurotoger / julkinen alue Isopentano on apolaarinen, hydrofobinen ja syttyvä yhdiste. Sen haju on samanlainen kuin bensiinin, ja se on osa sen koostumusta, koska se lisää sen oktaania tai oktaanilukua. Se saadaan isomerointireaktiosta n-Pentano, vaikka se luonnollisesti saavutetaan harvoissa määrissä maakaasuvarannossa.
Iskentanoa jättäen syrjään erittäin syttyvän luonteensa, ei -toksisena aineena. Henkilö voi nauttia sen ja haistaa sen maltillisesti ennen kuin hänellä on ei -toivottuja oireita, kuten halu oksentaa ja huimausta. Isopentanoa löytyy partaveitsistä ja hiushoitoaineista.
[TOC]
Isopentano -rakenne
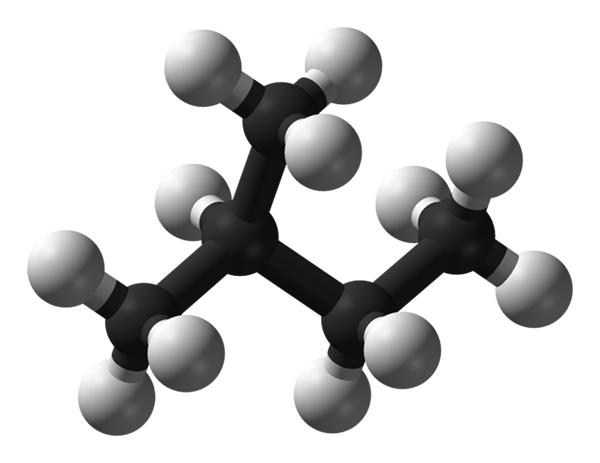 Isopentano -molekyylirakenne. Lähde: Benjah-BMM27 Wikipedian kautta.
Isopentano -molekyylirakenne. Lähde: Benjah-BMM27 Wikipedian kautta. Ylemmässä kuvassa meillä on isopentanon molekyylirakenne, jota edustaa malli pallo- ja palkkien malli. Mustat pallot vastaavat hiiliatomeja, kun taas valkoiset pallot vetyatomiin. Sen hiilihapotetusta luurankosta voidaan sanoa, että se on vankka, haarautunut ja tilaa vievä.
Voi palvella sinua: siirtymäreaktioCH -ryhmät ymmärtävät isopentano -molekyylin päät3, jotka ovat tehottomia molekyylien välisten vuorovaikutusten vahvistamisessa. Isopentano -molekyylit riippuvat Lontoon dispergoivista voimista ja niiden massoista pysyäkseen yhtenäisinä ja määrittelevät siten nesteen normaalissa lämpötilassa ja paineolosuhteissa.
Sen geometria ja ryhmät kuitenkin3 He vastaavat siitä, että isopentano -neste on erittäin haihtuva ja kiehuu lämpötilassa 28.2 ºC. Esimerkiksi lineaarinen isomeeri n-Pentano kiehuu noin 36 ° C.
Ilmeisestä kestävyydestään huolimatta isopentano -molekyyli pystyy omaksumaan useita avaruuskokoonpanoja, mikä on avaintekijä sen lasin määrittämisessä -160 ºC lämpötilassa -160 ºC.
Ominaisuudet
Fyysinen ulkonäkö
Nestemäinen tai väritön kaasu, vesipitoisella ulkonäöllä, ja se antaa myös samanlaisen hajun kuin bensiini. Se on erittäin haihtuva aine.
Sulamispiste
Isopentano kiteyttää lämpötilavälin välillä -161 --159 ºC.
Kiehumispiste
Isopentano kiehuu lämpötilavälillä 27.8 ja 28.2 ºC. Siksi se on tuskin altistunut astian ulkopuolelle, alkaa kiehua ja irrottaa suuret höyrymäärät.
Höyrynpaine
76.9 kPa 20 ° C: ssa (noin 0.76 ATM)
Tiheys
0 -.6201 g/ml 20 ° C: ssa. Isopentano -höyryt ovat 2.48 tiheämpi kuin ilma.
Liukoisuus
Isopentano apolaariseksi aineeksi on liukenematon ja sekoittumaton veden ja joidenkin alkoholien kanssa. Se on liukoinen ja sekoittuu parafiinisissa liuottimissa, eettereissä, hiilitetrakloridissa ja myös aromaattisissa nesteissä, kuten tolueeni.
Voi palvella sinua: kvaternääriset yhdisteet: ominaisuudet, koulutus, esimerkitTaitekerroin
1.354
Pintajännitys
15 dyn/cm 20 ºC: n lämpötilassa
Goo
0 -.214 CP 20 ° C: ssa
Leimahduspiste
-51 ºC. Tämä lämpötila tekee isopentanosta.
Itsensuuntainen lämpötila
420 ºC
Sovellukset
 Kieltovoiteet sisältävät pieniä isopentano -määriä, jotka toimivat ponneaineena ja antavat tuotteen tekstuurin. Lähde: Pixabay.
Kieltovoiteet sisältävät pieniä isopentano -määriä, jotka toimivat ponneaineena ja antavat tuotteen tekstuurin. Lähde: Pixabay. Isopentano on orgaaninen liuotin, joka toimii tiettyjen orgaanisten synteesien reaktiovälineinä ja edustaa myös raaka -ainetta muiden yhdisteiden tuottamiseksi.
Se lisätään bensiiniin oktaaninsa lisäämiseksi ja useisiin kosmeettisiin tuotteisiin sen tekstuurin parantamiseksi, kuten parranajovoiteet, kun ne nopeasti haihtuu ja jättää taaksepäin kuplivan massan.
Samoin polystyreeni kostutetaan isopentanoon siten, että haihtuessaan muovi laajenee luomaan eräänlainen vaahto, jolla alukset, mallit, levyt, tarjottimet jne.
Toisaalta isopentanoa käytetään kryogeeneissä, kuivan jään ja nestemäisen typen kanssa, biologisten kudosten ja näytteiden jäädyttämiseksi.
Saada
Isopentano voidaan saada maakaasusäiliöistä, vaikkakin vain 1% sen sisällöstä.
Toinen reitti, eniten käytetty teollisuustasolla, perustuu n-Öljynjalostusprosessien tisle Pentaneine. Sitten hän n-Pentano käy läpi erityisen reaktion nimeltään isomerointi.
Isomeroitumisen tarkoitus n-Pentanon on hankittava haarautuneimmat isomeerit. Siten niiden tuotteiden joukossa meillä ei ole vain isopentano, vaan myös neopentano. Tämä reaktio on mahdollista käyttämällä hyvin spesifisiä metallikatalyyttejä, jotka hallitsevat mitä lämpötilaa ja mitä painetta vaaditaan.
Se voi palvella sinua: kovalenttisten yhdisteiden ominaisuudet (esimerkkien kanssa)Riskejä
Isopentanoa pidetään ei -toksisena aineena. Tämä johtuu osittain sen alhaisesta reaktiivisuudesta, koska sen C-C- tai C-H-linkkejä ei ole helppo rikkoa, joten ne eivät häiritse sellaisenaan missään aineenvaihdunnassa. Itse asiassa henkilö pystyy hengittämään suuria määriä höyryään ennen tukahduttamista, ilman ilmeisesti kärsimystä vakuusvaurioista.
Hänen saanninsa aiheuttaa pahoinvointia ja oksentelua, ja hänen ihon kosketus loppuu. Toisaalta lääketieteelliset tutkimukset eivät ole pystyneet määrittelemään, onko isopentano syöpää aiheuttavaa ainetta. Sitä pidetään kuitenkin meren ekosysteemien ja heidän eläimistön vaarallisena epäpuhtauksena.
Suurin vaara isopentanon ympärillä ei ole niinkään sen reaktiivisuus, vaan syttyvyys: se palaa ilman hapen kanssa. Ja koska sen neste on erittäin haihtuva, pienin paeta irrottaa monet sen höyryistä ympäristöä kohti, mikä sytyttää liekin tai muun lämmön lähteen vähiten läheisyyttä.
Siksi isopentanoa sisältäviä tuotteita on säilytettävä turvallisissa ja tuoreissa ympäristöissä.
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10th Painos.-A. Wiley Plus.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Morrison ja Boyd. (1987). Orgaaninen kemia. (Viides painos). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Isopentaani. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2020). Isopentaani. Pubchem -tietokanta. CID = 6556. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Elsevier B.V. (2020). Isopentaani. Tiede. Haettu: ScienEdirect.com
- Jennifer B. Galvin & Fred Marashi. (2010). 2-metyylibutaani (isopentaani). Toksikologian ja ympäristöterveyden lehti, osa nykyisiä kysymyksiä. Volume 58, 1999 -Note 1-2. doi.org/10.1080/009841099157403
- « Saponifatiiviset lipidien ominaisuudet, rakenne, toiminnot, esimerkit
- Ammatillisen etiikan ominaisuudet, merkitys, koodi, esimerkit »

