Adsorptio -isotermit käsite, tyypit, esimerkit

- 3989
- 757
- Juan Breitenberg V
Se Adsorptioisotermit Ne ovat graafisia esityksiä adsorboituneen hiukkasen käyttäytymisestä kiinteän tai nesteen pinnalla, kun sen pitoisuus lisääntyy. Jos adsorboituneet hiukkaset vastaavat kaasua, sen paine otetaan huomioon.
Tarkkailemalla tätä isotermia voidaan ottaa ajatus adsorptioprosessista; Ja siksi miten hiukkasten pinnan vuorovaikutukset ja pintaominaisuudet ovat. Isotermin analysointi johdetaan, jos pinta on sileä, huokoinen tai mikrohuokoinen, samoin kuin mahdolliset kondensaatiot.
 Adsorptioisotermien kaavioon tai rakentamiseen tarvittavat komponentit. Lähde: Gabriel Bolívar.
Adsorptioisotermien kaavioon tai rakentamiseen tarvittavat komponentit. Lähde: Gabriel Bolívar. Ylivoimainen kuva auttaa selventämään edellä mainittua. Adsorboituneet hiukkaset (violetti ympyrät) ovat niin kutsuttuja adsorbaatteja. Adsorbentti on se, jolla on alue, jolla adsorboivat adsorboivat. Paineesi tai pitoisuuden kasvaessa, sitä suurempi adsorboitu tilavuus adsorbentin yli.
Tämä yksinkertainen esitys vastaa tyypin I isotermin kuvaamaa adsorptiota. Isotermien avulla tutkitaan kaasujen adsorptioita tai geeleissä olevia nestemäisiä äärettömiä, kiinteitä aineita tai katalyyttejä.
[TOC]
Tyypit adsorptioisotermit
 Adsorptioisotermit kaasu- ja kiinteät järjestelmät. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Adsorptioisotermit kaasu- ja kiinteät järjestelmät. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Viisi S: n käyttämistä pääkokeista isotermeistä on esitetty yllä. Brunauer luokitella kaasumaiset hiukkaset kiinteisiin aineisiin. Jokainen kuvaa erilaista adsorptioprosessia. Jokaisessa on myös matemaattisia malleja, jotka pyrkivät päättämään käyrien käyttäytymisen.
X (P/PO) ja Y (x) -akselissa käytetyt yksiköt tai muuttujat, X -akseli osoittaa, kuinka paljon painetta tai adsorbaattien ”Acts” -painetta tai muuntamista kiinteään; Vaikka Y -akseli, sanoo, kuinka suuri osa siitä adsorbaatista todella adsorboitiin mainitun kiinteän tai adsorbentin pinnalla.
Se voi palvella sinua: kuparisulfaatti (CUSO4): rakenne, ominaisuudet, hankkiminen, käyttöSiten, kun siirrymme X -akselin oikealle puolelle, näemme kuinka adsorboituneiden hiukkasten määrä kasvaa niiden paineiden tai pitoisuuksien lisääntymisestä riippuen. Tämä johtaa maksimiin, rappeutumiseen, laaksoon jne., että jotenkin tai toinen sallii tulkita kuinka adsorptio tapahtuu.
Tyypin I isotermi
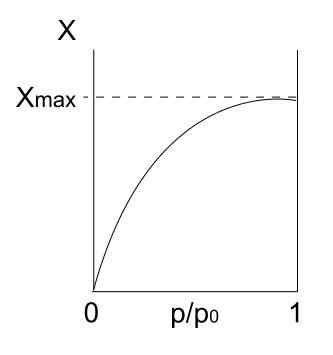 Tyypin I isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Tyypin I isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Meillä on tyypin I isotermi, joka tunnetaan myös nimellä Langmuir -isotermi, koska sen malli ennusti tämän käyrän muotoa. Nähdessään sen tulkitaan heti, että adsorboituneiden hiukkasten enimmäismäärä (xmax), joka ei vaihtele riippumatta siitä, kuinka paljon paineet kasvavat.
Tämä suurin adsorptioarvo voi johtua useista syistä. Yksi niistä on, että kemisorkti tapahtuu, mikä tarkoittaa, että hiukkaset tai adsorbaatit sitoutuvat voimakkaasti kiinteän tai adsorbentin pintaan. Kun pinnalla ei ole enää tilaa lisäämään hiukkasia, adsorptiota ei ole enää.
Sitten sanotaan, että yksikerros on muodostettu (kuten ensimmäisen kuvan purppura ympyrät).
Toinen syy tyypin I isotermin perustelemiseen on, että fisisorptio tapahtuu, mikä tarkoittaa, että hiukkasten pinnan vuorovaikutukset ovat erittäin heikkoja (ne eivät tarkoita kemiallisten sidosten muodostumista).
Tässä tapauksessa hiukkaset lopulta saapuvat mikroporoihin, jotka on täytetty, pinnalla ei ole enemmän paikkoja seuraaville adsorktioille; Eli sitä on saatavana vain vähän ulkoista aluetta (ikään kuin se olisi erittäin hieno hila). Tätä käyttäytymistä havaitaan, kun mikrohuokoisia jauheita analysoidaan.
Voi palvella sinua: pii: historia, ominaisuudet, rakenne, hankkiminen, käyttöTyyppi isotermi II
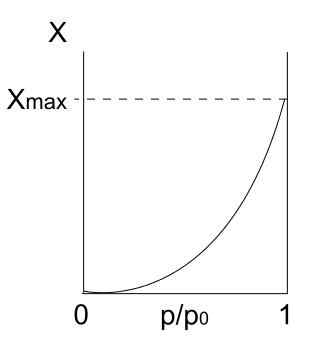
 Tyypin II isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Tyypin II isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Ylös meillä on tyypin II isotermi, joka tunnetaan myös nimellä sigmoidisotermi. Tämä kuvaa fysioprosesseja sekä ei -portaita kiinteitä että makrohuokoisia kiinteitä aineita.
Huomaa, että alussa se muistuttaa aikaisempaa isotermia, mikä tarkoittaa, että adsorboituneet hiukkaset muodostavat yksikerroksen adsorbenttipinnalle. Kun yksikerros on valmis, muut hiukkaset adsorboitetaan entisen päälle, mikä johtaa monikerroksisiin. Tällöin näemme tämän isotermin ominaisen lisääntymisen (oikealla).
Toinen syy siihen, miksi tyypin II isotermi saadaan, on se, että hiukkaset tuntevat suuremman affiniteetin pintaan kuin itse. Eli yksikerroksinen (hiukkaset-superficie) on vakaampi ja kestävämpi kuin monikerroksiset (hiukkasten partiperit) myöhemmin.
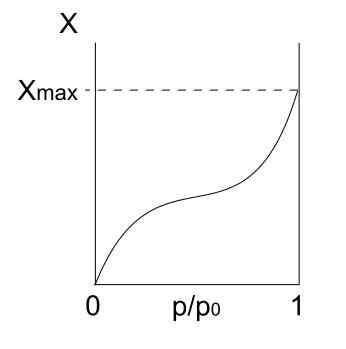
Tyyppi isotermi III
 Tyypin III isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Tyypin III isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Tyypin III isotermi on samanlainen kuin tyyppi II sen tulkinnan suhteen: Multicapas ja Physis. Tällä kertaa multicapas -vuorovaikutukset ovat kuitenkin vahvempia kuin yksikerroksinen, jolla on kiinteä. Siksi se on epäsäännöllinen adsorptio, jossa on adsorboituneiden hiukkasten ja vapaiden pintaosien kukkulat.
Tyyppi isotermi IV
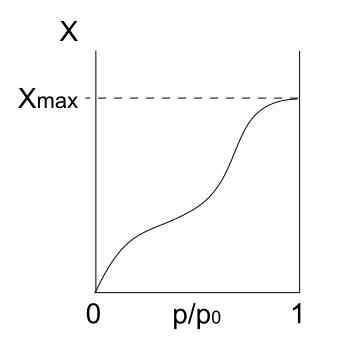 Tyypin IV isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Tyypin IV isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Tyypin IV isotermi kuvaa myös fisisorptiota ja monikerroksisia prosesseja, jotka näyttävät tyypin II isotermiltä; Mutta nyt huokoisissa (ja mesoporousissa) kiinteissä aineissa, joissa kaasumaisten hiukkasten kondensoituminen on mahdollista pienissä nestemäisissä volyymeissa. Kunnes nestemäinen huokos on "peitetty", yksikerros ei ole valmis.
Voi palvella sinua: Elintarvikekemia: Opintokenttä, elementit, sovelluksetTyyppi isotermi V
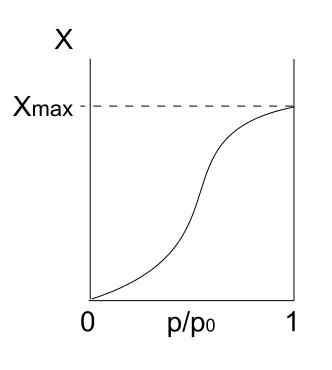 Tyypin V isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Tyypin V isotermi. Lähde: Daniele Pugliesi/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0) Tyypin V isotermi on samanlainen kuin tyyppi IV, vain tällä kertaa multicapas -muodostelmat ovat alttiimpia kuin vastaava Mono Forpa. Eli se muistuttaa tyypin III isotermin kuvaamaa adsorptiota. Täällä MultiCapa saavuttaa maksimin paksuuden, jossa ei ole paikkoja lisää hiukkasia adsorboida.
Esimerkit
Joitakin esimerkkejä kaasu-kiinteistä järjestelmistä mainitaan alla kokeellisissa tutkimuksissa saatujen isotermien tyypin vieressä:
-Ammoniakki-hiili (tyyppi I)
-Typpi-zeoliitit (tyyppi I)
-Vety-hiili korkeissa lämpötiloissa (tyyppi I)
-Hiilen happi-negro (tyyppi I)
-Piidioksidin typpi (tyyppi II)
-Typpih-hoerro (tyyppi II)
-Piidioksidi-bromi-geeli (tyyppi III)
-Piidiomiodihöyry (tyyppi III)
-Typpipoliittinen (tyyppi III)
-Kripton-negro hiilen (tyyppi IV)
-Ferrioksidin bentseenigeeli (tyyppi IV)
-Vesihöyry-hiili (tyyppi V)
Huomaa, että mainitut kiintoaineet olivat hiili, musta hiili, metallinen rauta, rautaoksidi, zeoliitit ja silikageeli. Ne kaikki ovat hyviä esimerkkejä adsorbenteista, joissa on erilaisia teollisia sovelluksia.
Viitteet
- Walter J. Moore. (1963). Fysikaalinen kemia. Termodynamiikassa ja kemiallisessa tasapainossa. (Neljäs Ed.-A. Longmanit.
- Iranin. Levine. (2009). Fysikaalis -periaatteet. Kuudes painos, sivu 479-540. MC Graw Hill.
- Glassi. (1970). Fysikaalisen kemian oppikirja. Toinen painos. D -d. Van Nostrand, Company, Inc.
- Yksikkö 3. Pintailmiöt. (S.F.-A. Adsorptio. [PDF]. Palautettu: DEPA.Fquim.Yksinäinen.MX
- Lowell S., Shields J.JA. (1984) Adsorptio -isotermit. Julkaisussa: Jauheen pinta -ala ja huokoisuus. Springer, Dordrecht.
- Elsevier B.V. (2020). Adsorptio isotermi. Tiede. Haettu: ScienEdirect.com
- Wikipedia. (2020). Adsorptio. Haettu: vuonna.Wikipedia.org

