Joseph Thomson

- 3665
- 1112
- Louis Moen
 J -.J -. Thomson
J -.J -. Thomson Joseph John Thomson (1856-1940) Se oli brittiläinen kemisti. Hän voitti Nobelin fysiikan palkinnon vuonna 1906.
Hän syntyi Cheetam Hillissä, Manchesterin alueella, Englannissa, 18. joulukuuta 1856. Tunnetaan myös nimellä "J.J -."Thomson opiskeli tekniikkaa Owens Collegessa, joka on tällä hetkellä osa Manchesterin yliopistoa, ja sitten matematiikka Cambridgessa.
Vuonna 1890 J.J -. Thomson meni naimisiin Rose Elizabeth Paget, tohtori Sir Edward George Pagetin tytär, jonka kanssa hänellä oli kaksi lasta: tyttö, nimeltään Joan Paget Thomson, ja lapsi, George Paget Thomson.
Jälkimmäisestä tulee kuuluisa tutkija, joka saa vuonna 1937 fysiikan Nobel -palkinnon heidän työstään elektronien kanssa.
Nuoresta iästä lähtien Thomson keskittyi opintoihinsa atomien rakenteesta, löytäen siten elektronien ja isotooppien olemassaolon monien muun muassa heidän panoksistaan.
Vuonna 1906 Thomson sai Nobel -palkinnon fysiikasta "tunnustaen hänen teoreettisen ja kokeellisen tutkimuksensa suuren ansiosta sähkön johtamisesta kaasujen kautta", kuten tuomaristo on perustanut edellä mainitun palkinnon tuomiossa.
Vuonna 1908 Britannian kruunu nimitti hänet ritariksi ja hän toimi fysiikan kunniaprofessorina Cambridgessa ja Lontoossa sijaitsevan kuninkaallisen instituutin.
Hän kuoli 30. elokuuta 1940 83 -vuotiaana Cambridgen kaupungissa, Englannissa. Fyysikko haudattiin Westminsterin luostariin, lähellä Sir Isaac Newtonin hautaa.
Joseph Thomsonin osuudet tieteeseen ja kemiaan
Elektronien löytö
Vuonna 1897 J.J -. Thomson löysi uuden kevyen hiukkasen kuin vety, joka kastettiin "elektroniin".
Voi palvella sinua: Tuhkaan määrittäminen: menetelmät ja esimerkitVetyä pidettiin atomipainon mittausyksikkö. Siihen saakka atomi oli pienin aineen jako.
Tässä mielessä Thomson löysi ensimmäisenä negatiivisesti kuormitetut ruumiin subatomiset hiukkaset.
Thomson Atomic -malli
Thomsonin atomimalli oli rakenne, jonka englantilainen fyysikko omistettiin atomeille. Tiedemiehelle atomit olivat positiivinen varausalue.
Siellä oli upotettuja negatiivisesti jakautuneita elektroneja tasaisesti kyseisessä positiivisessa kuormituspilvessä, ts. Atomi -taikinan positiivisen kuorman neutralointi.
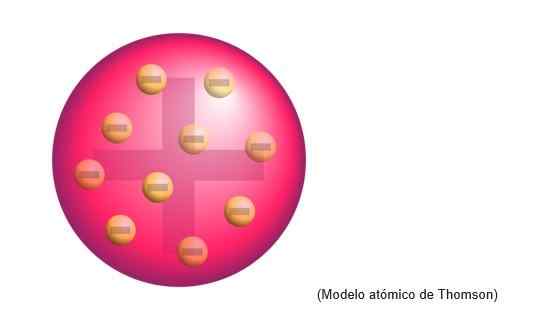
Tämä uusi malli korvaa Daltonin yksityiskohtaisen, ja myöhemmin Rutherford, Thomsonin opetuslapsi Cavendish Laboratories, kumoaa myöhemmin Cambridgen Cavendish Laboratories.
Atomien erottaminen
Thomson käytti positiivisia tai anodisia säteitä atomien erottamiseksi eri massasta. Tämä menetelmä antoi hänelle mahdollisuuden laskea kunkin atomin kuljettaman sähkön ja molekyylien lukumäärän kuutiometriä kohti.
Erilaisten massan ja kuormituksen atomit jakamaan fyysikko löysi isotooppien olemassaolon. Myös tällä tavalla hän tuotti positiivisia säteitä, hän tuotti suurta edistynyttä massaspektrometriaa.
Isotooppien löytäminen
J -.J -. Thomson huomasi, että neonioneilla oli erilaisia massoja, toisin sanoen erilainen atomipaino. Näin Thomson osoitti, että neonissa on kaksi isotooppien alatyyppiä, neon-20 ja neon-22.
Isotoopit, jotka tutkitaan tähän päivään saakka, ovat saman elementin atomeja, mutta niiden ytimillä on erilainen massamäärä, koska ne koostuvat keskuksensa eri määristä neutroneja.
Kokeet katodisäteillä
Katodisäteet ovat elektronivirroita tyhjiöputkissa, ts. Lasiputket, joissa on kaksi elektrodia, yksi positiivinen ja yksi negatiivinen.
Voi palvella sinua: Kromihydroksidi: rakenne, ominaisuudet, synteesi, käyttääKun negatiivista elektrodia lämmitetään, nimeltään myös katodi, se emittoi säteilyä, joka on suunnattu kohti positiivista elektrodia tai anodia, suorassa viivassa, jos kyseisellä reitillä ei tapahdu magneettikenttää.
Jos putken lasiseinät peitetään fluoresoivalla materiaalilla, katodien vallankaappaus kyseistä kerrosta tuottaa valon projektion.
Thomson tutki katodisäteiden käyttäytymistä ja pääsi johtopäätöksiin, että säteet levisivät suoraan.
Hän päätteli myös, että nämä säteet voidaan ohjata heidän etenemisestään magneetin, ts. Lisäksi säteet voivat siirtää terät kiertävien elektronien lujuudella, mikä osoittaa, että elektronit olivat massaa.
J -.J -. Thomson kokenut kaasun katodisäteputken sisällä, mutta elektronien käyttäytyminen ei vaihdellut. Samoin katodisäteet lämmittivät esineitä, jotka olivat interliäät elektrodien väliselle tielle.
Yhteenvetona voidaan todeta, että Thomson oli osoittanut, että katodisäteillä oli kevyitä, mekaanisia, kemiallisia ja lämpövaikutuksia.
Katodisäteputket ja niiden valoominaisuudet olivat transsendenttiset putkitelevision (CTR) ja videokameroiden keksinnölle.
Massaspektrometri
J -.J -. Thomson loi ensimmäisen lähestymistavan Massaspektrometri. Tämä työkalu mahdollisti tiedemiestutkimuksen.
Tämän tutkimuksen avulla hän päätteli, että katodisäteet koostuivat negatiivisista kuormituskysymyksistä, jotka ovat atomien sisällä, postittaen siten atomin jaettavuuden ja aiheuttaen elektronikuviota.
Se voi palvella sinua: Butihappo: kaava, ominaisuudet, riskit ja käyttötarkoituksetMyös massaspektrometrian edistyminen jatkui tähän päivään saakka, kehittyen eri menetelmissä elektronien erottamiseksi atomista.
Lisäksi Thomson ehdotti ensimmäisenä Ensimmäinen aaltoopas vuonna 1893. Tämä koe koostui leviämisestä.
Aaltooppaita käytetään laajasti tulevaisuudessa, jopa tänään, tiedonsiirron ja optisen kuidun avulla.
Thomsonin perintö
Thomson (TH) perustettiin massaspektrometrian massalatausyksikkönä, jonka ehdottivat kokit ja rockwood-kemikaalit, Thomsonin kunniaksi.
Tämä tekniikka mahdollistaa aineen molekyylien jakautumisen määrittämisen niiden massan mukaan ja tunnusta tällä, joita on läsnä aineena olevassa näytteessä.
Thomson Formula (TH):
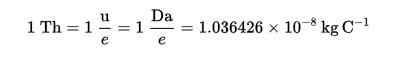
Erinomaiset teokset
- Sähkön irrottaminen kaasujen kautta, sähkö kaasujen kautta (1900).
- Aineen korpuskulaarinen teoria, kemian ja muistojen elektroni (1907).
- Elektronin ulkopuolella (1928).
Viitteet
- Nobel Media AB (2014). J -. Thomson - Biografinen. Nobel palkinto.org. Nobel palkinto.org.
- Thomson, Joseph J., Sähkö kaasukäyttäytymisen kautta. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Alkeishiukkasten hienovarainen viehätys.
- Christen, Hans Rudolf, Yleisen ja epäorgaanisen kemian perusteet, osa 1. Barcelona, Espanja. Editions Reverté S.-Lla., 1986.
- Arzani, Aurora Cortina, Yleinen yleinen kemia. Meksiko, Porrúa -toimitus, 1967.
- R -. G. Kokit, a. Lens. Rockwood. Nopea kunta. Massaspektri. 5, 93 (1991).

