Leusiinin ominaisuudet, rakenne, toiminnot, biosynteesi
- 4805
- 1103
- Alonzo Kirlin
Se Leusiini Se on yksi 22 aminohapposta, jotka muodostavat elävien organismien proteiinit. Tämä kuuluu yhteen yhdeksästä välttämättömästä aminohapposta, joita keho ei ole syntetisoitu ja joka on kulutettava ruokavalioon nautittuun ruokaan.
Ranskan apteekki ja kemisti kuvasivat Leucinan ensimmäisen kerran vuonna 1818. Lens. Proust, joka kutsui sitä "oksidikohtaiseksi". Myöhemmin Erlenmeyer ja Kunlin valmistivat sen a-bentsoilamido-β-isopropilakryylihaposta, jonka molekyylinen kaava on C6H13NO2NO2.
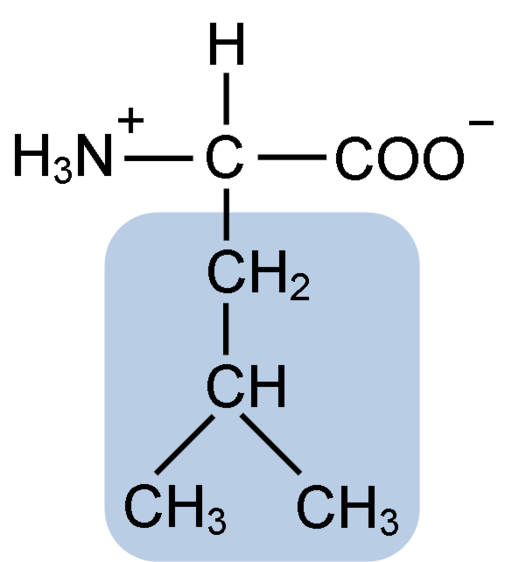
 Leusiinin aminohapon kemiallinen rakenne (fueeni: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Leusiinin aminohapon kemiallinen rakenne (fueeni: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Leusiini oli avain proteiinin translaation tunteen löytämisen aikana, koska sen hydrofobinen rakenne antoi biokemisti Howard Dentziksen merkitsemään radioaktiivisesti hiilen 3 vetyä ja tarkkailemaan merkitystä, jossa aminohapot sisällytetään hemoglobiinin peptidisynteesiin.
Leucinan "vetoketjullinen" tai "sulkeminen" tunnetut proteiinit ovat yhdessä "sinkkisormien" kanssa eukaryoottisten organismien tärkeimmät transkriptiotekijät. Leusiini -vetoketjut ovat ominaista niiden hydrofobiset vuorovaikutukset DNA: n kanssa.
Yleensä leusiinia runsaat proteiinit tai haarautuneiden aminohappojen muodostumat eivät metaboloitu maksassa, vaan ne menevät suoraan lihaksiin, joissa niitä käytetään nopeasti proteiinisynteesiin ja energian hankkimiseen.
Leusiini on haarautuneen ketjun aminohappo, joka on tarpeen maidon proteiinien ja aminohappojen biosynteesille, jotka syntetisoidaan rintarauhasissa. Löydät suuria määriä tätä vapaata aminohappoa rintamaitoa.
Kaikkien proteiinien muodostavien aminohappojen joukossa leusiini ja arginiini ovat kaikkein runsaimmin ja molemmat on havaittu kaikkien elämänpuun muodostavien valtakuntien proteiineissa.
[TOC]
Ominaisuudet
Leusiini tunnetaan haarautuneen ketjun olennaisena aminohappona, se jakaa tyypillisen rakenteen muiden aminohappojen kanssa. Se on kuitenkin erotettu, koska sen sivuketju- tai R -ryhmässä on kaksi kytkettyä hiilyä, ja viimeinen on kytketty vetyatomiin ja kahteen metyyliryhmään.
Se kuuluu polaaristen aminohappojen ryhmään ilman kuormaa, näiden aminohappojen substituentit tai R -ryhmät ovat hydrofobisia ja ei -polaarisia luonnetta. Nämä aminohapot ovat tärkein vastuussa protefisista hydrofobisista vuorovaikutuksista ja pyrkivät stabiloimaan proteiinien rakennetta.
Kaikkia aminohappoja, joilla on keskeinen hiili, joka on kiraalinen (hiili α), ts. Sillä on neljä erilaista yhtenäistä substituenttia, niitä löytyy luonteeltaan kahdella eri tavalla; Siten on olemassa D- ja L-Leucina, jälkimmäisiä tyypillisiä proteiinirakenteissa.
Kunkin aminohapon molemmilla muodoilla on erilaiset ominaisuudet, osallistuu erilaisiin aineenvaihduntareitteihin ja ne voivat jopa muuttaa rakenteiden ominaisuuksia.
Esimerkiksi L-Leucinan leusiinilla on hiukan katkera maku, kun taas D-leusiinin muodossa se on erittäin makea.
Minkä tahansa aminohapon muoto on helpompi metaboloida nisäkkäiden runko. L-Leucina on helposti hajotettu ja hyödynnetään proteiinien rakentamiseen ja suojaamiseen.
Rakenne
Leusiini koostuu 6 hiiliatomista. Keskimmäinen hiili, yleinen kaikissa aminohapoissa, on kytketty karboksyyliryhmään (COOH), aminoryhmään (NH2), vetyatomiin (H) ja sivuketjuun tai R R -ryhmään, joka koostuu 4 hiiliatomista.
Voi palvella sinua: MesotelioAminohappojen hiiliatomit voidaan tunnistaa kreikkalaisilla kirjaimilla. Numerointi alkaa karboksyylihappo (COOH) hiilestä, kun taas merkintä kreikkalaisen aakkosten kanssa alkaa keskushiilestä.
Leusiinilla on substituenttiryhmänä R-ketjussa r isobutyyli- tai 2-metyylipropiiliryhmään, jota tuotetaan vetyatomin menetyksellä, alkyyliradikaalin muodostumisen myötä; Nämä ryhmät ilmenevät aminohapparakenteen seurauksina.
Funktiot
Leusiini on aminohappo, joka voi toimia ketogeenisenä prekursorina muille sitruunahapposykliin osallistuville yhdisteille. Tämä aminohappo on tärkeä lähde asetyyli-CoA: n tai asetoasetyyli-CoA: n synteesille, jotka ovat osa maksasolujen ketonirunkojen muodostumisreittejä.
On tiedossa, että leusiini on välttämätöntä insuliinin signalointireiteillä, jotka osallistuvat proteiinisynteesin alkuun ja välttää proteiinin menetyksen hajoamisesta johtuen.
Yleensä proteiinien sisäiset rakenteet koostuvat hydrofobisista aminohapoista, kuten leusiini, valiini, isoleusiini ja menetelmä. Tällaiset rakenteet säilyvät yleensä elävien organismien yhteisille entsyymeille, kuten sytokromi c: n tapauksessa.
Leusiini voi aktivoida rintarauhanen solujen metabolisia reittejä laktoosisynteesin stimuloimiseksi, lipidejä ja proteiineja, jotka täyttävät toiminnot, kuten signalointimolekyylit nuorten energia -homeostaasin säätelyssä nisäkkäissä.
Leusiinirikkaat domeenit ovat olennainen osa spesifisiä DNA: ta sitovia proteiineja, jotka ovat yleensä rakenteellisia halkaisijoita super -ilmoittautuneella tavalla ja jotka tunnetaan nimellä "leusiini -vetoketjuproteiinit".
Näillä proteiineilla on erottuva ominaisuus toistuvien leusiinien säännöllinen malli yhdessä muiden hydrofobisten aminohappojen kanssa, jotka ovat vastuussa transkriptiotekijöiden ammattiliittojen säätelemisestä DNA: han ja eri transkriptiotekijöiden välillä.
Leucin Zip -proteiinit voivat muodostaa homo-tai heterodimeerejä, jotka sallivat heille.
Biosynteesi
Kaikki haarautuneet ketjun aminohapot, mukaan lukien leusiini, syntetisoidaan pääasiassa kasveissa ja bakteereissa. Kukkakasveissa leusiinin tuotanto lisääntyy merkittävästi, koska se on tärkeä edeltäjä kaikille yhdisteille, jotka vastaavat kukien ja hedelmien aromista.
Yksi leusiinin suuresta runsaudesta johtuvista tekijöistä eri bakteeripeptideissä on, että leusiinin (UUA-Uug-Ucu-cuc-cua-cug) 6 erilaista koodon koodin 6 erilaista koodonia, sama pätee myös arginiiniin.
Leusiini syntetisoidaan bakteereissa viiden askeleen reitistä, joka käyttää lähtökohtana valiniin liittyvää ketakidia.
Tätä prosessia säädetään alosterisesti, joten kun solun sisällä on ylimääräinen leusiini, se estää reittiin osallistuvia entsyymejä ja pysäyttää synteesin.
Voi palvella sinua: Simpson -hakemisto: kaava, tulkinta ja esimerkkiBiosinattinen reitti
Leusiinin biosynteesi bakteereissa alkaa Valinin johdannaisen ketakidin, 3-metyyli-2-oksobutanoatin (2S) -2-isopropilmalaatin, muuntamalla entsyymin 2-isopropilmalto-syntan vaikutuksen ansio -Coa ja vesi tätä tarkoitusta varten.
(2S) -2-isopropilmalaaaatti menettää vesimolekyylin ja transformoituu 2-isopropilmaleaatiksi 3-isopropyylimalaattidehydraasilla. Seuraavaksi sama entsyymi lisää toisen vesimolekyylin ja muuttaa 2-isopropilmaleaton (2R-3S) -3-isopropilmiksi.
Jälkimmäiselle yhdisteelle altistetaan hapettumisreaktio, joka ansaitsee NAD+-molekyylin osallistumisen, joka tuottaa (2S) -2-isopropil-3-oksosuccination, joka on mahdollista entsyymin 3-isopropilmalatin delebrogenaasin osallistumalla.
(2S) -2-Osopropyyli-3-oksosuccination menettää hiiliatomin CO2: n muodossa spontaanisti tuottaen 4-metyyli-2-oksopentanoaatin, joka on haarautuneiden ketjun aminohappojen transaminaasin vaikutuksesta (erityisesti), erityisesti), erityisesti). Ja L-glutamaatin ja 2-oksoglutaraatin samanaikaisen vapautumisen myötä se tuottaa L-Leucina.
Heikkeneminen
Leusiinin päätehtävänä on toimia signalointina, joka kertoo solulle, että aminohappoja ja energiaa on riittävästi lihasproteiinien synteesin aloittamiseksi.
Haarautuneiden ketjun aminohappojen hajoaminen leusiinina alkaa transaminaatiolla. Tämä ja kaksi seuraavaa entsymaattista vaihetta katalysoivat kolme entsyymiä leusiinin, isoleusiinin ja valiinin tapauksessa.
Kolmen aminohapon transaminointi tuottaa näiden a-ekootoakidiset johdannaiset, joihin kohdistuu oksidatiivinen dekarboksylaatio, jotta saadaan asyyli-CoA-tioérit, jotka ovat α, β-dishytydrafioituja tioés de acil-coA α, β-tarttumattomien suorittamiseen.
Leusiinikatabolismin aikana vastaava asyyli-CoA-paljastaja, β-tyydyttymätön β-insatura (HMG-COA), joka on välittäjä kolesterolin biosynteesissä ja muissa isoprenoideissa.
Leucinan katabolinen reitti
Akoli-CoA-setän α muodostumisesta β-tyydyttymättömiä, jotka johtuvat leusiinista tämän aminohapon kataboliset reitit ja valiini ja isoleusiini eroavat huomattavasti.
Acyyli-CoA-ucion α, β-tyydyttymätön leucina prosessoituu alavirtaan kolmella erilaisella entsyymillä, jotka tunnetaan nimellä (1) 3-metyylikrotonyyli-CoA-karboksylaasi, (2) 3-metyyliglutaconiil-CoA-hydatasa ja (3) 3-hydroksi -3-metyyliglutarilia -Coa liasa.
Bakteereissa nämä entsyymit ovat vastuussa 3-metyylikrotonyyli-CoA: n (leusiinijohdannaisen) muuntamisesta 3-metyyliglutaconiil-CoA: ssa, 3-hydroksi-3-metyyliglutariil-CoA: ssa ja asetaasettassa ja asetyyli-CoA: ssa, vastaavasti vastaavasti.
Veressä saatavana olevaa leusiinia hyödynnetään lihaksen/myofibrillaaristen proteiinien (MPS) synteesiin. Tämä toimii tämän prosessin aktivoivana tekijänä. Myös vuorovaikutuksessa suoraan insuliinin kanssa, vaikuttaen
Leusiinirikkaat ruuat
Rikkaiden aminohappoproteiinien kulutus on välttämätöntä elävien organismien solufysiologialle, ja leusiini ei ole poikkeus välttämättömien aminohappojen joukossa.
Meijeriseerumista saatuja proteiineja pidetään rikkaimpana L-Leucina-tähteissä. Kaikki elintarvikkeet, joissa on runsaasti proteiinipitoisuutta, kuten kalat, kana, munaa ja punainen liha, tarjoavat kuitenkin runsaasti leusiinia keholle.
Voi palvella sinua: Virusten lisääntyminen: vaiheet ja ominaisuudetViljan maissi on huono lysiini- ja tryptofaanin aminohapoissa, siinä on erittäin jäykät tertiääriset rakenteet ruuansulatukseen ja sillä on vähän arvoa ravitsemuksellisesta näkökulmasta, mutta siinä on korkea leusiini- ja isoleusiinitasot.
Palkokasvien hedelmät sisältävät runsaasti melkein kaikkia välttämättömiä aminohappoja: lysiini, treoniini, isoleusiini, leusiini, fenyylialaniini ja valiini, mutta niissä on vähän menetelmä- ja kysteiinipitoisuutta.
Leusiini uutetaan, puhdistetaan ja keskittyy tabletteihin elintarvikkeiden lisäravinteina korkean kilpailun urheilijoille, ja sitä markkinoidaan lääkkeenä. Tämän aminohapon eristämisen päälähde vastaa soijajauhoja.
Urheilijoiden käyttämää ravitsemuslisäainetta on käyttänyt lihaksen uudistamista, joka tunnetaan nimellä BCAA (englanti "Haaroitettu ketjun aminohappo "-A. Tämä tarjoaa korkeat pitoisuudet haarautuneita ketjun aminohappoja: Leucina, Valina ja Isoleucine.
Saannisi edut
Leusiinirikkaat elintarvikkeet auttavat hallitsemaan liikalihavuutta ja muita aineenvaihduntatauteja. Monet ravitsemusterapeutit huomauttavat, että tämän aminohappoon perustuvia leusiini- ja ravitsemuslisäaineita koskevat elintarvikkeet edistävät ruokahalun ja ahdistuksen säätelyä aikuisilla.
Kaikki leuciinirikkaat proteiinit stimuloivat lihasproteiinisynteesiä; On osoitettu, että nautitun leusiinin osuuden lisääntyminen muihin olennaisiin aminohappoihin nähden voi kääntää proteiinisynteesin vaimennuksen vanhusten potilaiden lihaksissa.
Jopa ihmiset, joilla on vakavia makulaushäiriöitä, jotka ovat halvaantuneet.
Leusiini, valiini ja isoleusiini ovat massan välttämättömiä komponentteja, jotka muodostavat selkärankaisten eläinten luuston lihaksen, joten niiden läsnäolo on elintärkeää uusien proteiinien synteesille tai ennen olemassaolon korjaamiseksi.
Puutoshäiriöt
Α-Zo-the-dehydrogenaasikompleksin puutteet tai epämuodostumat, jotka ovat vastuussa leusiinin, valiinin ja isoleusiinin metaboloinnista, voi aiheuttaa vakavia mielenterveyden häiriöitä.
Lisäksi näiden haarautuneiden ketjun aminohappojen aineenvaihduntaan liittyy patologinen tila, jota kutsutaan "virtsan sairauteen arce -siirappihaju".
Tähän päivään mennessä haittavaikutusten olemassaoloa liialliseen leusiinin kulutukseen ei ole osoitettu. Suositellaan kuitenkin enimmäisannosta 550 mg/kg päivittäin, koska mainitulle aminohapolle ei ole tehty pitkään aikavälin tutkimuksia liialliseen kudoksen altistumiseen.
Viitteet
- Álava, m. D -d. C., Camacho, m. JA., & Delgadillo, J. (2012). Lihasten terveys ja sarkopenian ehkäisy: proteiinin, leuciinin ja ß-hydroksi-ß-metyylibutiraatin vaikutus. Luu- ja mineraalien aineenvaihduntalehti, 10(2), 98-102.
- Fenheme tai. R -. (1993). Elintarvikekemia (Ei. 664: 543). Vetoomus.
- Massey, L. K -k -., Sokatch, J. R -., & Conrad, R. S. (1976). Haarautuneen aminohapon katabolismi bakteereissa. Bakteriologiset arvostelut, 40(1), 42.
- Mathews, c. K -k -., & Ahern, k. G. (2002). Biokemia. Pearson -koulutus.
- Pelkkä, a. (1999). Leusiinilisäys ja intensiivinen koulutus. Urheilulääketiede, 27(6), 347-358.
- Munro, H. N. (Ed.-A. (2012). Nisäkkäiden proteiinien aineenvaihdunta (Vol. 4). Elsevier
- Nelson, D. Lens., Lehninger, a. Lens., & Cox, M. M. (2008). Lehninger -biokemian periaatteet. Macmillan.

