Olut-lambert-laki
- 3651
- 760
- Eddie Hackett
Mikä on Beer-Lamben laki?
Se Olut-lambert-laki (Beer-Bouguer) on sellainen, joka liittyy yhden tai useamman kemiallisen lajin sähkömagneettisen säteilyn imeytymiseen sen pitoisuuksilla ja etäisyydellä, joka kulkee valoa hiukkasfotonin vuorovaikutuksissa. Tämä laki yhdistää kaksi lakia yhteen.
Bouguerin laki (vaikka tunnustaminen on laskenut enemmän Heinrich Lambertista), toteaa, että näyte absorboi suuremman säteilyn, kun absorboivan tai aineellisen ympäristön mitat ovat suurempia; Erityisesti sen paksuus, joka on etäisyys lens Se kulkee valon läpi saapuessasi ja menossa ulos.
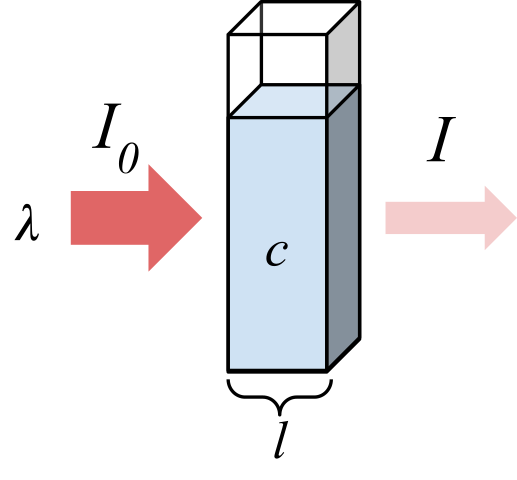 Säteily, joka absorboi näytteen. Lähde: Marmot2019 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons
Säteily, joka absorboi näytteen. Lähde: Marmot2019 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)], Wikimedia Commons Ylivoimainen kuva näyttää yksivärisen säteilyn imeytymisen; eli koostuu yhdestä aallonpituudesta, λ. Absorboiva väliaine on optisen solun sisällä, jonka paksuus on lens, ja sisältää kemiallisia lajeja pitoisuudella c.
Valonsäteellä on alku- ja lopullinen intensiteetti, joka on nimetty symboleilla I0 - Ja minä, vastaavasti. Huomaa, että kun olet vuorovaikutuksessa absorboivan väliaineen kanssa, olen vähemmän kuin minä0 -, joka osoittaa, että säteilyn absorptio oli. Mitä vanhempia he ovat c ja lens, Pienempi olen I: n suhteen0 -; ts. imeytymistä on enemmän ja vähemmän läpäisy.
Selitys Beer-Lamben laista
Ylivoimainen kuva kattaa tämän lain täydellisesti. Säteilyn imeytyminen näytteessä kasvaa tai vähenee eksponentiaalisesti riippuen c jompikumpi lens. Jotta lain on täysin ja helppo ymmärtää, on tarpeen rajata sen matemaattiset näkökohdat.
Kuten juuri mainittiin, minä0 - Ja minä olen yksivärisen valonsäteen intensiteetit ennen ja jälkeen valoa ja sen jälkeen. Jotkut tekstit mieluummin käyttävät P -symboleja0 - ja p, joka viittaa säteilyenergiaan eikä sen voimakkuuteen. Tässä selitys jatkaa intensiteettien käyttöä.
Voi palvella sinua: asetofenoniTämän lain yhtälön linearisoimiseksi on sovellettava logaritmia, yleensä pohja 10:
Loki (i0 -/I) = εlc
Termi (i0 -/I) osoittaa, kuinka paljon absorptiotuotteen voimakkuus vähenee. Lambertin laki tarkastelee vain L (εl), kun taas Beer's ohittaa l, mutta paikkoja c Sen sijaan (εc-A. Korkeampi yhtälö on molempien lakien liitto, ja siksi se on olut-lambe-lain yleinen matemaattinen ilmaisu.
Absorbanssi ja läpäisevyys
Absorbanssi määritellään termi loki (i0 -/Yo). Siten yhtälö ilmaistaan seuraavasti:
A = εlc
Missä ε on sukupuuttoon tai molaarinen absorbaatio, joka on vakio tietyllä aallonpituudella.
Huomaa, että jos absorboivan paksuus pysyy vakiona, aivan kuten ε, absorbanssi riippuu pelkästään pitoisuudesta c, absorboivia lajeja. Lisäksi se on lineaarinen yhtälö, y = mx, missä ja on A, ja x On c.
Kun absorbanssi kasvaa, läpäisevyys vähenee; Tämä on, kuinka paljon säteilyä onnistuu lähettämään absorption jälkeen. Siksi ne ovat käänteisiä. Joo0 -/I osoittaa imeytymisasteen, I/I0 - Se on yhtä suuri kuin läpäisy. Tämän tietäminen:
I/i0 - = T
(Yo0 -/I) = 1/t
Loki (i0 -/I) = loki (1/t)
Mutta loki (minä0 -/I) se on myös yhtä suuri kuin absorbanssi. Joten välinen suhde T on:
A = log (1/t)
Ja logaritmien ominaisuuksien soveltaminen ja tietäminen, että log1 on yhtä suuri kuin:
A = -logt
Yleensä lähetetyt lähetykset ilmaistaan prosentteina:
%T = i/i0 -∙ 100
Kaaviot
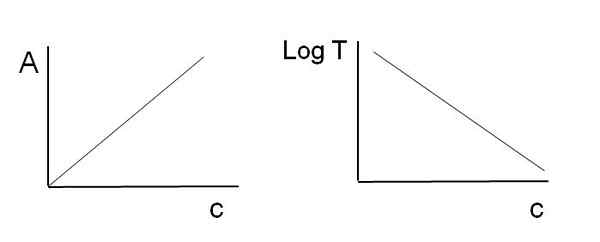
Kuten edellä todettiin, yhtälöt vastaavat lineaarista funktiota; Siksi odotetaan, että ne kuvaavat niitä linjan.
Voi palvella sinua: Mikä on kemiallinen kinetiikka? Grafiikka, jota käytetään Beer-Lambert -lakiin. Lähde: Gabriel Bolívar
Grafiikka, jota käytetään Beer-Lambert -lakiin. Lähde: Gabriel Bolívar Huomaa, että yllä olevan kuvan vasemmalla puolella on viiva, joka on saatu c, ja oikealla puolella LOGT -kuvaajaa vastaavaa linjaa c. Yhdellä on positiivinen kaltevuus ja toinen negatiivinen; Mitä suurempi absorbanssi, sitä pienempi läpäisy.
Tämän lineaarisuuden ansiosta absorboivien kemiallisten (kromoforeiden) lajien pitoisuus voidaan määrittää, tiedetäänkö, kuinka paljon säteilyä ne absorboivat (A) tai kuinka paljon säteilyä se välitetään (logt). Kun tätä lineaarisuutta ei havaita, sanotaan, että se kohtaa olut-Lambertin lain poikkeamaa, positiivista tai negatiivista.
Beer-Lambe -lakahakemukset
Yleisesti ottaen jäljempänä mainitaan joitain tämän lain tärkeimmistä sovelluksista:
-Jos kemiallisilla lajeilla on väriä, se on esimerkillinen ehdokas, joka analysoidaan kolorimetrisillä tekniikoilla. Nämä perustuvat Beer-Lambert-lakiin ja sallii analyyttien pitoisuuden määrittämisen spektrofotometrillä saatujen absorbanssien perusteella.
-Se mahdollistaa kalibrointikäyrän rakentamisen, joiden kanssa otetaan huomioon näytteen matriisivaikutus, kiinnostavien lajien pitoisuus määritetään.
-Sitä käytetään laajasti proteiinien analysointiin, koska useilla aminohapolla on tärkeitä imeytymisiä sähkömagneettisen spektrin ultraviolettialueella.
-Kemialliset reaktiot tai molekyyliset ilmiöt, jotka tarkoittavat värityksen muutosta, voidaan analysoida absorbanssiarvojen avulla yhdellä tai useammalla aallonpituudella.
-Monimuuttuja -analyysin tekeminen, kompleksikromoforit -seokset voidaan analysoida. Tällä tavoin kaikkien analyyttien pitoisuus voidaan määrittää ja myös luokitella seokset ja erottaa ne toisistaan; Esimerkiksi sulje pois, tulevatko kaksi identtistä mineraalia samasta erityisestä mantereelta tai maasta.
Voi palvella sinua: vahva happoRatkaisut
Harjoitus 1
Mikä on liuoksen absorbanssi, joka esittelee 30%: n läpäisyn aallonpituuteen 640 nm?
Sen ratkaisemiseksi siirry vain absorbanssin ja läpäisyn määritelmiin.
%T = 30
T = (30/100) = 0,3
Ja tietäen, että a = -logt, laskelma on suora:
A = -log 0,3 = 0,5228
Huomaa, että sinulta puuttuu yksiköitä.
Harjoitus 2
Jos edellisen vuoden liukeneminen koostuu lajista W, jonka pitoisuus on 2,30 ∙ 10-4 M, ja olettaen, että solun paksuus on 2 cm: mikä pitäisi olla sen pitoisuus 8%: n läpäisyn saamiseksi?
Se voidaan ratkaista suoraan tällä yhtälöllä:
-Logt = εlc
Mutta ε: n arvoa ei tunneta. Siksi se on laskettava aikaisempien tietojen kanssa, ja oletetaan, että se pysyy vakiona monilla pitoisuuksilla:
ε = -logt/lc
= (-Log 0,3)/ (2 cm x 2,3 ∙ 10-4 M)
= 1136,52 m-1∙ cm-1
Ja nyt voit jatkaa laskemista prosentilla t = 8:
C = -Logt/εl
= (-Log 0,08)/ (1136,52 m-1∙ cm-1 x 2cm)
= 4,82 ∙ 10-4 M
Sitten riittää, että W -lajit kaksinkertaistavat sen pitoisuuden (4,82/2,3) vähentämään läpäisevyysprosenttiaan 30–8%.
Viitteet
- Olut-lambert-laki. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Olut-lambert-laki. Talteenotettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- « Sosiaalinen darwinismi mikä on, ominaisuudet, kirjoittajat, seuraukset
- Myrskyjen ja hurrikaanien seuraukset ekosysteemissä »

