Ihanteellisten kaasujen laki kaava ja yksiköt, sovellukset, esimerkit

- 1137
- 297
- Ronald Reilly
Se Ihanteelliset kaasulakia Se on tilayhtälö, joka kuvaa ihanteelliseen kaasuun liittyvien tilatoimintojen välistä suhdetta; kuten lämpötila, paine, tilavuus ja moolit. Tämä laki antaa mahdollisuuden tutkia todellisia kaasumaisia järjestelmiä vertaamalla niitä idealisoituihin versioihinsa.
Ihanteellinen kaasu on teoreettinen kaasu, joka koostuu spesifisistä tai pallomaisista hiukkasista, jotka liikkuvat satunnaisesti; Suuri kineettinen energia, missä ainoa vuorovaikutus niiden välillä on täysin joustavat yhteenotot. Lisäksi ne noudattavat ihanteellista kaasulakia.
 Ihanteellinen kaasulaki mahdollistaa monien todellisten kaasumaisten järjestelmien tutkimuksen ja ymmärtämisen. Lähde: Pxhere.
Ihanteellinen kaasulaki mahdollistaa monien todellisten kaasumaisten järjestelmien tutkimuksen ja ymmärtämisen. Lähde: Pxhere. Tavanomaisessa paineessa ja lämpötilassa (STP): 1 atm paine ja lämpötila 0 ºC, useimmat todelliset kaasut käyttäytyvät laadullisesti ihanteellisina kaasuina; edellyttäen, että niiden tiheydet ovat alhaiset. Suuret molekyylien väliset tai interatomiset etäisyydet (jalokaasuille) helpottavat tällaisia lähestymistapoja.
STP -olosuhteissa happi, typpi, vety, jalokaasut ja jotkut yhdistelmäkaasut, kuten hiilidioksidi, käyttäytyvät kuin ihanteellinen kaasu.
Ihanteellisella kaasumallilla on taipumus epäonnistua alhaisissa lämpötiloissa, korkeissa paineissa ja suurissa osissa; Kun molekyylien väliset vuorovaikutukset, samoin kuin hiukkasten koko, tulevat tärkeiksi.
Ihanteellinen kaasulaki on koostumus kolmesta gase-laista: Boylen ja Mariotten laki, Charlesin ja Gay-Lussacin laki ja Avogadron laki.
[TOC]
Kaava ja yksiköt

Kaasujen laki ilmaistaan matemaattisesti kaavan kanssa:
Pv = nrt
Missä P -paine kohdistetaan kaasulla. Se ilmaistaan yleensä ilmakehän yksiköllä (ATM), vaikka se voidaan ilmaista muissa yksiköissä: MMHG, Pascal, Bar jne.
Kaasun miehittämä osa V ilmaistu yleensä litran yhtenäisyydellä (l). Sillä aikaa n Se on moolien lukumäärä, r kaasujen yleinen vakio ja t Kelvinissä ilmaistu lämpö (k).
R -kaasujen eniten käytetty ekspressio vastaa 0,08206 L · ATM · K-1· Mol-1. Vaikka kaasun vakion yksikön arvo on 8 3145 J · mol-1· K-1. Molemmat ovat voimassa niin kauan kuin ne ovat varovaisia muiden muuttujien yksiköiden kanssa (P, T ja V).
Ihanteellinen kaasulaki on yhdistelmä Boyle-Maleotten lakia, Charles-Gay-Lussacin lakia ja Avogadron lakia.
Boyle-Maleotte Law
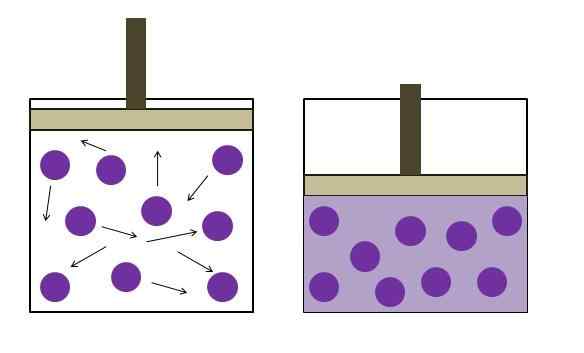 Lisääntynyt paineen vähentämispaine. Lähde: Gabriel Bolívar
Lisääntynyt paineen vähentämispaine. Lähde: Gabriel Bolívar Sen muotoilivat itsenäisesti fyysikko Robert Boyle (1662) ja fyysinen ja kasvitieteilijä Edme Mariotte (1676). Laki ilmoitetaan seuraavasti: vakiolämpötilassa kaasun kiinteän massan tilavuus on käänteisesti verrannollinen siihen kohdistuvaan paineeseen.
Voi palvella sinua: terpenosPV ∝ K
Käyttämällä kahta pistettä:
P1V1 = P2V2
Charles-Gay-Lussac -laki
 Kiinalaiset lyhdyt tai toiveet. Lähde: Pxhere.
Kiinalaiset lyhdyt tai toiveet. Lähde: Pxhere. Lain julkaisi Gay-Lussac vuonna 1803, mutta viittasi työhön, jota Jacques Charles ei julkaissut (1787). Tästä syystä laki tunnetaan nimellä Charlesin laki.
Laissa todetaan, että vakiopaineessa kaasun ja sen lämpötilan käyttämän tilavuuden ja sen lämpötilan välillä on suora suhteellinen suhde.
V ∝ K2T
Käyttämällä kahta pistettä:
V1/T1 = V2/T2
V1T2 = V2T1
Avogadro -laki
Lain totesi Amadeo Avogadro vuonna 1811 huomauttaen, että kaikkien kaasujen yhtä suuret määrät, samassa paineessa ja lämpötilassa, on sama määrä molekyylejä.
V1/n1 = V2/n2
Mikä vahvistaa ihanteellisen kaasulakin?
Ihanteellisen kaasulain kautta luodaan neljän riippumattoman fysikaalisen ominaisuuden välinen suhde: paine, tilavuus, lämpötila ja kaasun määrä. Riittää, kun tiedät kolmen arvon, jotta saadaan jäljellä oleva.
Laki vahvistaa olosuhteet, jotka osoittavat, kun kaasu käyttäytyy ihannetapauksessa, ja kun se siirtyy pois tästä käytöksestä.
Esimerkiksi So -called Compression -kertoimen (PV/NRT) arvo on 1 ihanteellisille kaasuille. Kompressiokerroksen arvon arvon arvo osoittaa, että kaasun käyttäytyminen siirtyy pois ihanteellisesta kaasusta.
Siksi virhettä tehdään, kun sovelletaan ihanteellisia kaasuyhtälöä kaasulle, joka ei käyttäytyy mallin mukaan.
Sovellukset
Kaasun tiheyden ja molaarimassan laskeminen
Ihanteellisen kaasulain yhtälöä voidaan käyttää kaasun tiheyden ja sen moolimassan tiheyden laskemisessa. Kun teet yksinkertaista muutosta, löydät matemaattisen lausekkeen, joka liittyy kaasun tiheyteen (d) ja sen molaarimassaan (M):
D = MP/RT
Ja puhdistaminen m:
M = drt/p
Kemiallisessa reaktiossa tuotetun kaasun tilavuuden laskeminen
Stokiometria on kemian haara, joka liittyy kemialliseen reaktioon osallistuvien reagenssien määrän, yleensä ekspressoituna moolissa.
Ihanteellisten kaasuyhtälön käyttö mahdollistaa kemiallisessa reaktiossa tuotetun kaasun tilavuuden määrittämisen; Koska kemiallisesta reaktiosta voit saada moolien lukumäärän. Sitten kaasun tilavuus voidaan laskea:
Voi palvella sinua: Lasi -ionomeeri: valmistelu, ominaisuudet, tyypit, käyttötarkoituksetPv = nrt
V = nrt/p
V: n mittaus voi määrittää mainitun reaktion suorituskyvyn tai edistymisen. Kun kaasuja ei ole enää, on osoitus siitä, että reagenssit ovat täysin uupuneet.
Seoksessa olevien kaasujen osittaisten paineiden laskeminen
Ihanteellista kaasua koskevaa lakia voidaan käyttää yhdessä Daltonin osittaisen paine -lain kanssa laskemaan kaasuseoksessa olevien eri kaasujen osittaiset paineet.
Suhdetta sovelletaan:
P = nrt/v
Kunkin seoksessa olevien kaasujen paineen löytäminen.
Vedessä kerätyn kaasun tilavuus
Tehdään reaktio, joka tuottaa kaasua, joka kerätään kokeellinen suunnittelu vedessä. Kaasun kokonaispaine tunnetaan sekä vesihöyryn paine. Viimeksi mainitun arvo voidaan saada taulukosta ja vähentämällä kaasupaine voidaan laskea.
Kemiallisen reaktion stökiometriasta voidaan saada kaasun moolien lukumäärä ja suhde: suhde:
V = nrt/p
Tuotetun kaasun tilavuus lasketaan.
Esimerkkejä laskelmista
Harjoitus 1
Kaasun tiheys on 0,0847 g/l - 17 ºC ja paine 760 torr. Mikä on molaarinen massa? Mikä on kaasu?
Aloitamme yhtälöstä
M = drt/p
Muunna ensin lämpötilayksiköt Kelviniksi:
T = 17 ºC + 273,15 K = 290,15 K
Ja 760 Torr -paine vastaa 1 atm: n painetta. Nyt sinun on vain vaihdettava arvot ja ratkaistava:
M = (0,0847 g/l) (0,08206 l · atm · k-1· Mol-1) (290,15 K) / 1 atm
M = 2 016 g/mol
Tämä molaarimassa voi vastata yhtä lajia: Diatominen vetymolekyyli, H2.
Harjoitus 2
Massa 0,00553 g elohopeaa (Hg) kaasufaasissa on 520 litraa ja lämpötilassa 507 K. Laske HG: n kohdistama paine. Hg: n massa on 200,59 g/mol.
Ongelma ratkaistaan yhtälöä käyttämällä:
Pv = nrt
Tietoja HG: n moolien lukumäärästä ei näy; Mutta ne voidaan saada käyttämällä molaarimassansa:
Molit Hg = (0,00553 g Hg) (1 mol Hg/200,59 g)
Voi palvella sinua: happi: ominaisuudet, rakenne, riskit, käyttötarkoitukset= 2 757 · 10-5 Moolit
Nyt meidän on vain puhdistettava p ja korvattava arvot:
P = nrt/v
= (2 757 · 10-5 Moolit) (8 206 · 10-2 L · atm · k-1· Mol-1) (507 K)/ 520 L
= 2,2 · 10-6 Pankkiautomaatti
Harjoitus 3
Laske suolahapon tuottama paine, joka on tuotettu reagoimalla 4,8 g kloorikaasua (Cl2) vetykaasulla (H2), 5,25 l: n tilavuudessa ja lämpötilassa 310 K. Cl: n molaarimassa2 on 70,9 g/mol.
H2 g) + Cl2 g) → 2 HCl(g)
Ongelma ratkaistaan käyttämällä ihanteellisia kaasuyhtälöä. Mutta HCl: n määrä ilmaistaan grammina eikä moolina, joten asianmukainen muutos tehdään.
Moolit HCl = (4,8 g Cl2) (1 mol Cl2/70,9 g cl2) (2 mol hcl/1 mol cl2-A
= 0,135 moolia HCL: tä
Ideal Gases -lain yhtälön soveltaminen:
Pv = nrt
P = nrt/v
= (0,135 moolia HCl: ta) (0,08206 l · atm · k-1· Mol-1) (310 K) / 5,25 l
= 0,65 atm
Harjoitus 4
Kaasumaisen yhdisteen 0,130 g: n näytteessä on 140 ml tilavuus lämpötilassa 70 ºC ja paineessa 720 torr. Mikä on molaarinen massa?
Ihanteellisen kaasun yhtälön soveltamiseksi useiden muutosten on ensin tehtävä:
V = (140 ml) (1 l/1000 ml)
= 0,14 l
Jos tilavuus on litraa, nyt sinun on ilmaista lämpötila Kelvinissä:
T = 70 ºC + 273,15 K = 243,15 K
Ja lopuksi, meidän on muutettava paine ilmakehän yksiköiksi:
P = (720 torr) (1 atm/760 torr)
= 0,947 atm
Ensimmäinen askel ongelman ratkaisemisessa on saada moolien lukumäärä yhdisteestä. Tätä varten käytetään ihanteellisten kaasujen yhtälöä ja puhdistimme n-
Pv = nrt
N = pv / rt
= (0,947 atm) (0,14 l) / (0,08206 l · atm · k-1· Mol-1) (243,15 K)
= 0,067 moolia
Molaarinen taikina on tarpeen laskea jakamalla grammat saatujen moolien välillä:
Molaarimassa = grammat yhdisteestä / moolien lukumäärä.
= 0,130 g / 0,067 moolia
= 19,49 g/mol
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Iranin. Levine. (2014). Fysikaalis -periaatteet. Kuudes painos. MC Graw Hill.
- Glassi. (1970). Fysikaaliset kemian sopimus. Toinen painos. Aguilar.
- Mathews, c. K -k -., Van Holde, K. JA., Ja ahern, k. G. (2002). Biokemia. 3was Painos. Pearson Addison Wesley toimitus.
- Wikipedia. (2019). Ihanteellinen kaasu. Haettu: vuonna.Wikipedia.org
- Toimitusryhmä. (2018). Boyle Law tai Boyle-Maleotte Law | Kaasulaki. Toipunut: iquimicas.com
- Jessie a. Avain. (S.F.-A. Ihanteellinen kaasulaki ja alahakemukset. Haettu osoitteesta: OpenTextbc.Ac

