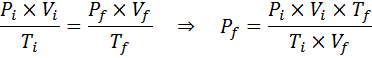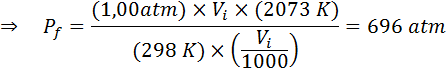Yleinen kaasulaki

- 2501
- 222
- Gabriel Fahey
Mikä on yleinen kaasulaki?
Se Yleinen kaasulaki, Joskus kutsutaan myös kaasujen yhdistetyksi laki, se on Boylen lakien, Charlesin ja Gay-Lussacin yhdistelmä. Se on laki, joka kuvaa paineen, lämpötilan ja kiinteän määrän ihanteellisen kaasun tilavuuden välistä suhdetta.
Tämän lain lausunnossa sanotaan:
”Jos kaasun moolien lukumäärä on vakio, paine-tilavuuden ja lämpötilatuotteen välinen suhde pysyy vakiona."
Matemaattisessa muodossa kaasujen yleinen laki ilmaistaan seuraavasti:
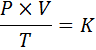
Jos p edustaa kaasun painetta, v.
Yleisen kaasulain vaihtoehtoiset muodot
Suhteellisuuslaki
Vaihtoehtoinen tapa ilmaista kaasujen yleistä lakia on suhteellisuuslaki:
"Minkä tahansa kiinteän määrän kaasua varten sen paineen ja sen tilavuuden tuote on suoraan verrannollinen lämpötilaan".
Se tarkoittaa, että:
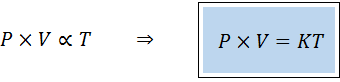
Tämä vastaa ensimmäisen yhtälön molempien jäsenten kertomista lämpötilan mukaan.
Alkuperäisen ja lopullisen tilan välinen suhde
Boylen, Charlesin ja Gay-Lussacin lakien tavoin yleinen kaasulaki voidaan ilmaista alkuperäisen valtion ja kaasun lopullisen tilan välisenä suhisena, joka tapahtuu valtion muutoksena.
Toisin kuin aiemmat lait, ei ole välttämätöntä, että mikään kolmesta muuttujasta ei pysy vakiona, vain moolien lukumäärä. Toisin sanoen PXV/T -suhde on sama alkuperäisessä tilassa, Yllyttää, ja viimeisessä tilassa, F. Toisin sanoen yleinen kaasulaki voidaan myös ilmaista matemaattisesti seuraavasti:
Se voi palvella sinua: Píchricihappo: Mikä on, rakenne, synteesi, ominaisuudet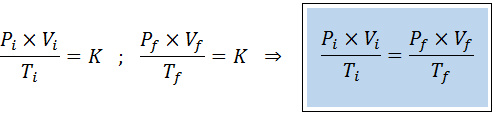
Yleisen kaasulain kaavan johdannainen
Kuten edellä mainittiin, yleinen kaasulaki tulee Boylen, Charlesin ja Gay-Lussacin lakien yhdistelmästä. Nämä lait on esitetty alla:
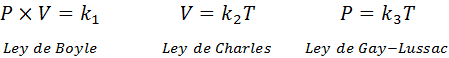
Jos jokaisesta näistä laeista puhdistamme vakiona k -k -, Ja sitten kerrotaan ne toistensa kanssa, saamme:
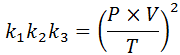
Nyt saadaan neliöjuuri, yleinen kaasulaki saadaan:
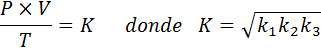
Kaasujen yleinen laki vs. Ihanteellisten kaasujen laki
General Gases -laki ihanteellisella kaasulakilla ei pidä sekoittaa. Huolimatta siitä, että yleinen kaasulaki on kaksi hyvin samankaltaista ja myös läheisesti liittyviä lakeja, se yhdistää vain Boylen, Charlesin ja Gay-Lussacin lait.
Ideal Gases -laki puolestaan lisää Avogadro -periaatteen, minkä mukaan "Samassa lämpötila- ja paine -olosuhteissa mitattujen kaasujen yhtä suuret määrät sisältävät saman määrän hiukkasia ”.
Seurauksena on, että lämpötilan, tilavuuden ja paineen yhdistämisen lisäksi ihanteellisen kaasun laki sallii myös näiden muuttujien liittyä hiukkasten lukumäärään tai kaasun mooliin, joten se edustaa tilan tilan tilan yhtälöä Ihanteelliset kaasut.
Seuraavissa yhtälöissä ero näiden kahden lain välillä voidaan havaita helpommin:

Huomaa, että tärkein ero molempien lakien välillä on, että ihanteellinen kaasulaki sisältää n, joka edustaa moolien lukumäärää ja myös vakion sijaan K, on Vakio r, joka on ihanteellisten kaasujen vakio.
Voi palvella sinua: terpenosVoisimme sanoa, että ihanteelliset kaasulaki on yleisempi kuin yleinen kaasulaki, koska sitä voidaan soveltaa minkä tahansa kaasun määrään minkä tahansa paine-, lämpötila- ja tilavuusolosuhteiden nojalla. Toisaalta yleisen kaasulain soveltaminen edellyttää, että kaasun määrä pysyy vakiona.
Esimerkkejä yleisen kaasulain soveltamisesta
Alla on joitain esimerkkejä tyypillisistä ongelmista, joissa yleistä kaasua koskevaa lakia voidaan soveltaa:
Esimerkki 1: vedenalainen ilmakupla
Oletetaan, että sukeltaja, joka on 20 m: n syvyydessä veden alla, jossa paine on 3,00 atm ja lämpötila 15 ° C vapauttaa ilman hengityksen ja yhden kuplista on alkutilavuus 100 cm3.
Määritä ilmakuplan tilavuus, kun se saavuttaa pinnan, joka on tavanomaisissa lämpötila- ja painolosuhteissa, olettaen, että kuplan sisällä oleva ilman määrä ei muutu, kun se nousee.
Ratkaisu
Ensinnäkin meidän on purettava kaikki tiedot lauseesta. On selvää, että kaasulle on kaksi erilaista tilaa, yksi alku ja yksi pää, joten erotamme tiedot kahteen ryhmään. Lämpötilat ovat myös välttämätöntä muuntaa absoluuttisessa lämpötilassa:

Koska ongelmassa määrittelee, että kaasun määrä (ilma) ei ole muutoksia, niin voimme soveltaa yleistä kaasulakia, josta voimme tyhjentää lopullisen määrän:
Voi palvella sinua: Rodio: Historia, ominaisuudet, rakenne, käyttö, riski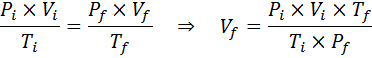
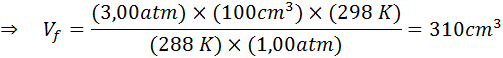
Siksi ilmakupla saavuttaa 310 cm: n tilavuuden3 Saavuttuaan pintaan.
Esimerkki 2: Korkea paine
Kuinka paljon ihanteellisen kaasun paine, joka on ympäristön lämpötilassa 25 ° C, ja paine 1,00 atm ja puristaa sen tilavuuden tuhannen osuuden samaan aikaan lämpötilaan 1800 ° C: seen suljetussa astiassa?
Ratkaisu
Kuten aikaisemmin, aloitamme purkamalla tiedot:

Kuten sanotaan, että prosessi suoritetaan suljetussa astiassa, kaasun määrä ei muutu, joten yleistä kaasulajaa voidaan soveltaa: