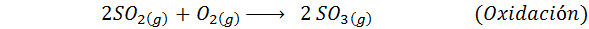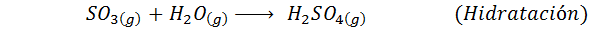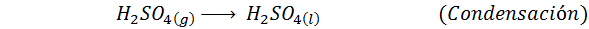Rikkihappo (H2SO4)

- 1455
- 135
- Gustavo Runte DVM
Selitämme, mikä rikkihappo, sen kemiallinen rakenne, ominaisuudet, miten se saadaan, sovellukset ja käyttöriskit ovat
 Rikkihappoveneet (H2SO4)
Rikkihappoveneet (H2SO4) Mikä on rikkihappo?
Hän rikkihappo, Kutsutaan myös vety sulfaatti- ja vitrioliöljy, se on oksasidinen rikihappo, joka muodostuu rikkihappoanhydridireaktiosta (niin3) ja vesi. Sen molekyyl kaava on H2Sw4 Ja se on ylivoimaisesti tuotetuin ja käytetty mineraalihappo.
Se on vahva ja erittäin syövyttävä mineraalihappo, joka sekoittuu veden kanssa, joten se voidaan valmistaa lähes minkä tahansa pitoisuuden liuoksina välillä 0 ja noin 18 molaarista.
Tämän yhdisteen korkeat tuotanto- ja kulutukset johtuvat sen monista sovelluksista, jotka ovat yhtä monipuolisia kuin maatalous, petrokemian teollisuus, orgaanisessa ja epäorgaanisessa synteesissä ja jäteveden hoidossa, vain joitain vain joitain.
Rikkihapporakenne
Rikkihappoa muodostuu keskusrikkiatomilla Valencia VI: llä, jota ympäröi 4 happiatomia, joista kaksi on kytketty vetyatomiin. Sen Lewisin rakenne on esitetty alla:
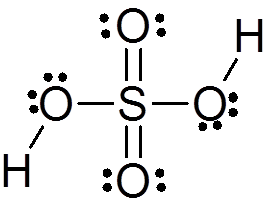
Kuten näette, rikkiä tässä yhdisteessä ympäröi 12 elektronia (6 paria), joten se edustaa yhtä Octet -säännön poikkeuksista.
Valencia (Trepev): n elektroniparien (Trepev) hylkäämisen teoria ennustaa 4 atomin ympäröimä, että tämän yhdisteen on oltava suunnilleen tetraedrinen geometria, joka on esitetty seuraavassa kuvassa:
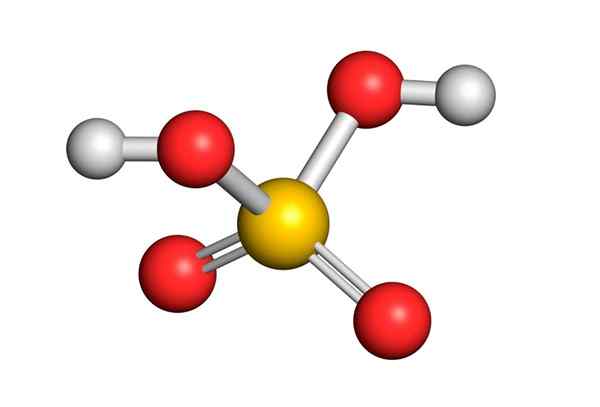
Hapen korkean elektronegatiivisuuden ja rikkihapon erilaisten resonanssirakenteiden vuoksi hapen ja hydrogien väliset sidokset ovat voimakkaasti polarisoituneita, mikä tekee niistä erittäin happamia ja helpoin.
Rikkihapon ominaisuudet
Sen rakenteen seurauksena rikkihapolla on seuraavat fysikaaliset ja kemialliset ominaisuudet:
Se voi palvella sinua: Epoksidi: nimikkeistö, hankkiminen, sovellukset, esimerkitFyysiset ominaisuudet
- Puhdas rikkihappo on väritön ja wc: n neste, jonka tiheys on 1 8302 g/ml.
- Sen sulamispiste on 10,31 ° C ja kiehuminen on 337 ° C, vaikka siinä lämpötilassa on taipumus hajottaa vettä ja rikkihydridiä (jota kutsutaan myös rikkitrioksidiksi).
- Se on täysin sekoittumassa veden kanssa, joten voit valmistaa ratkaisuja millä tahansa pitoisuudella. Liuokset, joiden happamassa on yli 98,3%, ovat epävakaita ja happo hajoaa, kunnes sen pitoisuus laskee 98,3%: iin. Tämä liuos on stabiili ja se tunnetaan konsentroituna rikkihappona.
- Puhtaalla tai väkevöidyssä tilassa se on viskoosisempi neste kuin vesi.
Kemialliset ominaisuudet
- Puhdas rikkihappo on voimakkaasti hapettunut ja syövyttävä aine. Sillä on kyky hapettua, kuivuttaa ja sulfonaria monenlaisiin orgaanisiin yhdisteisiin ja hiilihappoja.
- Se on vahva diproottinen happo, joka menettää kokonaan ensimmäisen protonin liuottamalla veteen, jolloin se on sen konjugoitu emäs, bisulfaatti -ioni (HSO4--A. Tämä ioni on myös happo, vaikkakin heikompi kuin alkuperäinen happo.
- Vesipitoiset rikkihappoliuokset ovat voimakkaasti happamia ja kykenevät liuottamaan monia metalleja tuottaen kaasumaista vetyä. He kykenevät myös neutraloimaan vahvat emäkset kokonaan.
- Reagoi väkivaltaisesti monien alkoholien ja veden kanssa, vapauttaen prosessissa suuria määriä lämpöä.
Kuinka rikkihappo saadaan?
Kolme tunnetuinta rikkihapon tuotantoprosessia ovat: kosketusprosessi, märkä rikkihappoprosessi ja lyijykameroiden prosessi.
1. Rikkihapposynteesi kosketusprosessin avulla
Tämä on nykyään eniten käytetty menetelmä rikkihapon tuottamiseksi. Prosessi koostuu viidestä vaiheesta, joissa elementaalisesta rikistä tulee rikkidioksidia (niin2), sitten rikkitrioksidi (niin3), disulfuriinihappo (H2S2JOMPIKUMPI7) ja lopuksi rikkihappossa. Reaktiot ovat:
Voi palvella sinua: mikä on turvallisuusromu ja mihin se on?
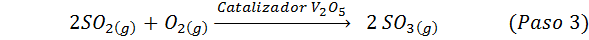


Prosessin toinen vaihe koostuu yksinkertaisesti rikkidioksidin puhdistuksesta ennen kuin ne muuttuvat rikki- tai rikkihydriditrioksidiksi. Kolmannen vaiheen reaktio tapahtuu, kun kaasumainen rikkidioksidi on kosketuksissa kiinteän vanadium -pentaoksidikatalyytin kanssa (V2JOMPIKUMPI5), Ja siksi menetelmää kutsutaan yhteysprosessiksi.
2. Rikkihapposynteesi märkäprosessin avulla
Tämä prosessi on suunniteltu puhdistamaan monenlaisten kemianteollisuuden ja kasvien päästökaasut. Tämän puhdistuksen sivutuote on kaupallinen luokka rikkihappo kuuman veden höyryn lisäksi, jota voidaan käyttää uudelleen alkuperäisessä teollisuusprosessissa.
Märän prosessin tapauksessa reaktiot ovat enimmäkseen. Kussakin vaiheessa tapahtuvat tärkeät reaktiot ovat:
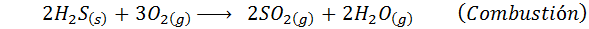
3. Rikkihapposynteesi lyijykameroiden prosessin avulla
Tämä on muinainen menetelmä rikkihappoa, jota käytetään nykyään hyvin vähän. Prosessin oli poltettava alkuavain rikki ilman hapen läsnä ollessa lyijypäällystetyissä puukammioissa, ja siten sen nimi.
Tämän palamisen jälkeen rikkidioksidi reagoi sitten natriumnitraatin hajoamisen aiheuttamien typpioksidien kanssa tai muilla keinoilla. Loppujen lopuksi saatiin lisäreaktioiden sarjan jälkeen rikkihappoa.
Voi palvella sinua: tasainen taustapulloYleiset sovellukset
- Rikkihapon pääasiallinen levitys on rikkilähde sulfaattien muodossa lannoitteiden valmistuksessa. Itse asiassa noin 60% maailmassa tuotetusta rikkihaposta on tarkoitettu tähän tarkoitukseen.
- Kemianteollisuudessa sitä käytetään pesuaineiden, pigmenttien, petrokemian teollisuuden katalyyttien ja mineraalien käsittelyyn erilaisten metallien saamiseksi.
- Lopuksi, rikkihappo on elektrolyytti, jota käytetään useimmissa autoissa käytetyissä lyijyakuissa.
Rikkihappoon liittyvät riskit
Kemiallisten ominaisuuksiensa vuoksi rikkihappo voi olla erittäin vaarallinen sekä ihmisille että eläimille ja ympäristölle yleensä. Nämä ovat joitain tähän kemikaaliin liittyvistä riskeistä:
- Sen syövyttävät ja kuivattuvat ominaisuudet tekevät puhdasta happoa aiheuttavat suuria vaurioita, jos se joutuu kosketukseen ihon kanssa.
- Toisaalta rikkihappon vesiliuoksen reaktio metallien kanssa tuottaa kaasumaista vetyä, joka on polttoaine- ja räjähtävä aine.
- Rikkihappo itsessään ei kärsi palamisreaktiosta, mutta vahva hapettiminen stimuloi muiden aineiden palamista, joka toimii eräänlaisena katalyyttinä, joten se edustaa huomattavaa paloriskiä.
- Lisäksi, kun se altistetaan tulipalolle, se voidaan jakaa myrkyllisiksi kaasuiksi ja tuottaa rikkihappohöyryjä, jotka voivat helposti tuhota hengitysteitä.
Näistä syistä ja muusta syystä rikkihappo on aine, jota tulisi käsitellä huolellisesti.