Meniski (kemia)
- 5017
- 610
- Gabriel Fahey
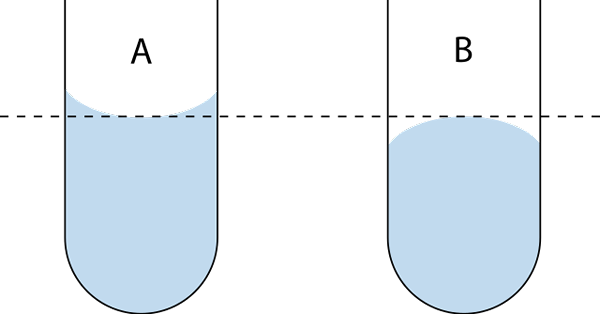
 Kovera ja kupera meniski. Lähde: Wikimedia Commons
Kovera ja kupera meniski. Lähde: Wikimedia Commons Mikä on meniski (kemia)?
Hän meniski Se on nesteen pinnan kaarevuus. Se on myös nesteen neste-ilma-rajapinnassa. Nesteille on ominaista kiinteä tilavuus, joka on kompensoiva.
Nesteiden muoto kuitenkin vaihtelee. Tämä ominaisuus johtuu niiden muodostavien molekyylien satunnaisesta liikkeestä.
Nesteillä on kyky virtaus, korkeatiheys ja leviävät nopeasti muihin nesteisiin, joiden kanssa ne ovat sekoittuvia.
Ne käyttävät astian alhaisinta pinta -alaa, jättäen vapaan, joka ei ole täysin tasainen pinta päälle. Joissakin olosuhteissa he voivat omaksua erityisiä muotoja, kuten tippoja, kuplia ja kuplia.
Nesteiden, kuten sulamispisteen, höyrynpaine, viskositeetin ja höyrystymisen lämpöä, ovat riippuvaisia molekyylien välisten voimien voimakkuudesta, jotka antavat koheesion nesteille.
Nesteet ovat kuitenkin myös vuorovaikutuksessa säiliön kanssa tarttuvuusvoimien kautta.
Sitten meniski syntyy näistä fysikaalisista ilmiöistä: erohiukkasten välinen koheesiovoimien ja tarttumisen välinen ero, joka antaa heille mahdollisuuden kastella seinämiä.
Mikä on meniski?
Kuten selitettiin, meniski on seurausta useista fyysisistä ilmiöistä, joista nesteen pintajännitys voidaan mainita myös.
Koheesiovoimat
Yhteesiovoimat ovat fyysinen termi, joka selittää molekyylien väliset vuorovaikutukset nesteen sisällä. Veden tapauksessa koheesiovoimat johtuvat dipoli-dipolo-vuorovaikutuksesta ja vety sillasta.
Voi palvella sinua: kloorioksidi (III): Ominaisuudet, rakenne, käyttöVesimolekyyli on kaksisuuntainen luonne. Tämä johtuu siitä, että molekyylin happi on elektronegatiivinen, koska sen elektroneista johtuva suurempi aviditeetti on suurempi kuin vety, mikä määrittää, että happi pysyy negatiivisella kuormalla ja hydrogenit ovat positiivisesti varautuneet.
Vesimolekyylin negatiivisen kuormituksen välillä on sähköstaattinen vetovoima, joka sijaitsee happea, ja toisen vesimolekyylin positiivisen kuormituksen välillä.
Tämä vuorovaikutus on se, mitä hän tietää dipoli-dipolin vuorovaikutuksena tai voimana, joka myötävaikuttaa nesteen yhteenkuuluvuuteen.
Tarttuvuusvoimat
Toisaalta vesimolekyylit voivat olla vuorovaikutuksessa lasiseinien kanssa vesimolekyylien vetyatomien osittaisella kuormalla, jotka sitovat lasin lasin pinnan happiatomeja happiatomeissa.
Tämä muodostaa nesteen ja jäykän seinämän välisen tarttuvuusvoiman, joka tarkoittaa puhekielistä, että neste kostaa seinää.
Kun silikoniliuos asetetaan lasipinnalle, vesi ei kyllästä kokonaan lasia, vaan muodostuu tähän joihinkin tippiin, jotka ovat helposti eliminoituneita.
Siten on osoitettu, että tällä käsittelyllä veden ja lasin välinen tarttuvuusvoima vähenee.
Hyvin samanlainen tapaus tapahtuu, kun kädet ovat öljyisiä, ja kun peset niitä vedellä, iholla näkyy erittäin määriteltyjä tippoja kostutetun ihon sijasta.
Tyypit Meniskit
Meniskiä on kahta tyyppiä: kovera ja kupera. Ylemmässä kuvassa kovera on a ja kupera b. Pisteviivat osoittavat oikean huuhtelun lueessasi äänenvoimakkuutta.
Voi palvella sinua: neutraali atomiKovera meniski
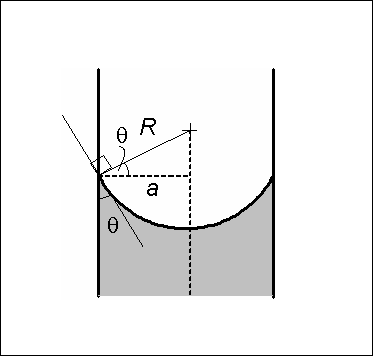 Kovera meniskin toimenpiteitä. Lähde: Wikimedia Commons
Kovera meniskin toimenpiteitä. Lähde: Wikimedia Commons Kovera meniski on karakterisoitu siinä mielessä, että kosketuskulma θ, joka muodostaa lasin seinämän tangenttiviivalla meniskille, joka johdetaan nesteen rintaan, on arvo alle 90º.
Jos lasille asetetaan nestemäinen määrä, sillä on taipumus levittää lasipinnalle.
Koveran meniskin läsnäolo.
Siksi neste ui tai kostuttaa lasiseinää, säilyttää määrän nestettä ja antaa meniskille koveraa. Vesi on esimerkki nesteestä, joka muodostaa koveran meniskin.
Kupera meniski
Kukkassa meniskissä kosketuskulman θ arvo on yli 90º. Elohopea on esimerkki nesteestä, joka muodostaa kuperan meniskin. Kun tippa elohopeaa asetetaan lasipinnalle, kosketuskulman θ arvo on 140º.
Kukkas meniskin havaitseminen. Sanotaan, että neste ei märkää lasia.
Yhteesion (neste-neste) ja tarttuvuuden (neste-kiinteä) pinnalliset voimat ovat vastuussa monista biologisen mielenkiinnon ilmiöistä, kuten pintajännityksen ja kapillaarisuuden tapaus.
Pintajännitys
Pintajännitys on nettovetovoima, joka on kohdistettu pinnalta löytyviin nestemolekyyleihin ja jolla on taipumus tuoda ne nesteeseen.
Voi palvella sinua: Diatomiset elementitSiksi pintajännityksellä on taipumus kohesimaan nestettä ja antamaan enemmän kovera meniskiä. Toisin sanoen tällä voimalla on taipumus poistaa lasiseinämän nesteen pinta.
Pintajännityksellä on taipumus laskea lämpötilan noustessa, esimerkiksi: Pintavesijännitys on yhtä suuri kuin 0,076 N/m A 0 ° C ja 0,059 N/m A 100 ° C.
Kun taas elohopean pintajännitys 20 ° C: ssa on 0,465 N/m. Tämä selittäisi, miksi Mercury Form Forms Convex Meniscus.
Kapillaarisuus
Jos kosketuskulma θ on vähemmän kuin 90º ja nesteen kostuttama lasiseinä, lasikapillaarien sisällä oleva neste voi nousta, kunnes saavuttaa tasapainoolosuhteet.
Nestemäisen pylvään painon kompensoi koheesiovoiman pystysuuntainen komponentti pintajännityksestä johtuen. Tarttuvuusvoima ei puutu, koska se on kohtisuorassa putken pintaan nähden.
Tämä laki ei selitä, kuinka vesi voi nousta juurista lehtiä ksylemisuonten läpi.
Oikeastaan tässä suhteessa on muitakin tekijöitä, esimerkiksi: Kun vesi haihtuu lehdissä, se sallii vesimolekyylien imemisen kapillaarien yläosassa.
Tämä antaa muiden kapillaarien pohjassa olevien molekyylien nousua miehittämään haihdutettujen vesimolekyylien sijainti.
Viitteet
- Whitten, Davis, Peck & Stanley. Kemia. Cengage -oppiminen.
- Helmestine, Anne Marie, PH.D -d. Kuinka lukea meniskiä kemiassa. Toipunut Ajatelukyvystä.com

