Myofibrillit ominaisuudet, rakenne, koostumus, toiminnot
- 3321
- 65
- Sheldon Kuhn
Se Myofibrillit Ne ovat lihassolujen rakenteellisia yksiköitä, jotka tunnetaan myös nimellä lihaskuidut. Ne ovat erittäin runsaasti, ne on kiinnitetty rinnakkain ja näiden solujen sytosoli upottaa ne.
Kannatut lihaskuidut solut tai kuidut ovat erittäin pitkiä soluja, jotka kykenevät mittaamaan jopa 15 cm pitkä ja halkaisijaltaan 10 - 100 μm. Sen plasmamembraani tunnetaan nimellä Sarcolema ja sen sytosoli sarkoplasmana.
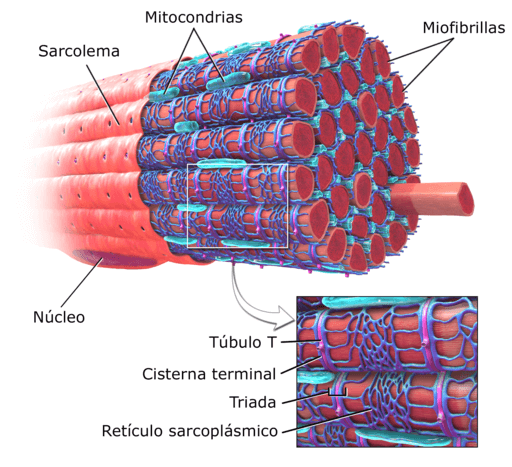
 Kaavio ihmisen lihasrakenteesta (lähde: Deglr6328 ~ commonswiki, Wikimedia Commons)
Kaavio ihmisen lihasrakenteesta (lähde: Deglr6328 ~ commonswiki, Wikimedia Commons) Näissä soluissa on myofibrillien lisäksi useita ytimiä ja mitokondrioita, jotka tunnetaan sarkosomeina, samoin kuin näkyvä endoplasminen retikulum, joka tunnetaan nimellä sarkoplasminen retikulum.
Myofibrillit tunnustetaan selkärankaisten eläinten lihaksen "supistuviksi elementeiksi". Ne koostuvat erityyppisistä proteiineista, jotka antavat heille joustavat ja sisäänvedettävät ominaisuudet. Lisäksi heillä on tärkeä osa lihaskuitujen sarkoplasmaa.
[TOC]
Erot lihaskuitujen välillä
Lihaskuituja on kahta tyyppiä: nauhoitettuja ja sileitä kuituja, jokaisella on anatominen jakauma ja erityinen funktio. Myofibrillit ovat erityisen tärkeitä ja ilmeisiä raidottuissa lihaskuiduissa, jotka muodostavat luurankojen lihaksen.
Rajallisilla kuiduilla on toistuva poikittaisten vyöhykkeiden malli, kun niitä havaitaan mikroskoopissa, ja ne liittyvät luuston lihaksiin ja osaan sydämen lihakseen.
Silevät kuidut päinvastoin eivät esiinny samaa kuviota mikroskoopin alla, ja niitä esiintyy verisuonten ja ruuansulatusjärjestelmän ominaispiirteissä (ja kaikissa sisäelimissä).
Yleiset luonteenpiirteet
Myofibrillit koostuvat kahden tyyppisistä supistuvista filamenteista (tunnetaan myös nimellä myofilamentit), jotka puolestaan koostuvat myosiinista ja aktiini -rihmuodollisista proteiineista, jotka kuvataan myöhemmin.
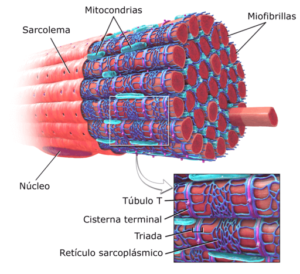 Myofibrillien graafinen esitys luustolihaksessa (lähde: modifioitu brublaus [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta)
Myofibrillien graafinen esitys luustolihaksessa (lähde: modifioitu brublaus [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta) Eri tutkijat ovat todenneet, että myofibrillien supistuvien proteiinien keskimääräinen käyttöikä kulkee viidestä päivästä 2 viikkoon, joten lihakset ovat erittäin dynaamisia kudoksia, ei vain supistuvan näkökulmasta, vaan sen rakenteellisten elementtien synteesin ja uusimisen perusteella.
Kunkin lihassolujen tai kuitujen myofibrillan funktionaalista yksikköä kutsutaan sarkroksi, ja se rajaa alue, joka tunnetaan nimellä “band tai linja z”, mistä aktiinin myofilamentit laajennetaan rinnakkain.
Koska myofibrillit vievät huomattavan osan sarkoplasmasta, nämä kuiturakenteet rajoittavat solujen keskuksen sijaintia, joihin ne kuuluvat saman, Sarcolema.
Se voi palvella sinua: ihmisen solu: ominaisuudet, toiminnot, osat (organelit)Jotkut ihmisen patologiat liittyvät ytimien siirtymiseen myofibrillaarispalkkeihin, ja nämä tunnetaan keskus-ydinvoiman myopatioina.
Myofibrillien tai "myofibrillogeneesin" muodostuminen
Ensimmäiset myofiilit kootaan alkion luurankojen kehittämisen aikana.
Saromarit (myofibrillien funktionaaliset yksiköt) muodostavat proteiinit ovat aluksi kohdistettuja "palkinnon" päistä ja puolilta, jotka koostuvat aktiinifilamenteista ja pienistä myosiini II -siirtolaisista ja α-spesifisestä lihaspesifisestä tekosta.
Kuten tämä tapahtuu, niiden ilmentämissä lihaskuiduissa eri mittasuhteissa a-aktiinin sydämen ja luuston isomuotojen koodaavat geenit. Ensin ilmaistun sydämen isoformin määrä on suurempi ja sitten tämä muuttuu luurankoon.
Palkinnon muodostumisen jälkeen syntyvät myofibrillit kootaan palkinnon muodostumisvyöhykkeen taakse ja näissä havaitaan lihaksikas myosiini II.
Tässä vaiheessa myosiinin filamentit ovat kohdistettuja ja monimutkaisia myosiiniliiton muiden spesifisten proteiinien kanssa, joita esiintyy myös aktiinifilamenteilla.
Rakenne ja koostumus
Kuten hetki sitten mainittiin, myofibrillit koostuvat supistuvista proteiinien myofilamenteista: aktiinista ja myosiinista, jotka tunnetaan myös vastaavasti ohuiksi ja paksuiksi myofilamenteiksi. Nämä ovat näkyvissä optisen mikroskoopin kannalta.
- Ohut myofilamentit
Myofibrillien ohuet filamentit koostuvat aktiiniproteiinista sen rihmuodossa (aktiini F), joka on polymeeri globaalissa muodossa (aktiini G), jolla on pienempi koko.
Aktiinin g (aktiini F) rihmeettiset säikeet muodostavat kaksoisjuosteen, joka on kääritty potkurin muotoon. Jokainen näiden monomeeri painaa enemmän tai vähemmän 40 kDa ja pystyy liittymään myosiiniin tietyissä paikoissa.
Näiden filamenttien halkaisija on noin 7 nm ja ne ulottuvat kahden alueen, joka tunnetaan nimellä bänd I ja bändi a. A -kaistalla nämä filamentit sijaitsevat paksujen filamenttien ympärillä, jotka muodostavat toissijaisen kuusikulmaisen järjestelyn.
Erityisesti jokainen ohut filamentti on symmetrisesti erotettu kolmesta paksusta filamentista, ja jokaista paksua filamenttia ympäröi kuusi ohutta filamenttia.
Ohut ja paksut filamentit ovat vuorovaikutuksessa keskenään "ristikontojen" kautta, jotka erottuvat paksuista filamenteista ja jotka ilmestyvät myofibrillan rakenteeseen säännöllisillä etäisyyksillä lähellä 14 nm.
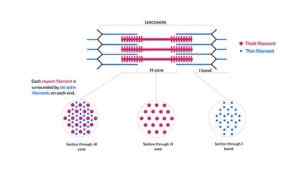 Kaavamainen esitys myofilamenteista, jotka muodostavat myofibrillit ja niiden ristileikkaukset (lähde: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Kaavamainen esitys myofilamenteista, jotka muodostavat myofibrillit ja niiden ristileikkaukset (lähde: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Aktiinifilamentit ja muut siihen liittyvät proteiinit ulottuvat z -linjojen "reunoista" ja päällekkäin myosiinilankojen kanssa kunkin sarkomeron keskustaa kohti.
Se voi palvella sinua: solujen ravitsemus: prosessi ja ravintoaineet- Paksut myofilamentit
Paksut filamentit ovat myosiini II -proteiinin polymeerejä (kumpikin 510 kDa), ja ne rajaavat alueet, jotka tunnetaan nimellä "nauhat A".
Myosiinin myosiinin myofilamentit ovat noin 16 nm pitkiä ja jakautuvat kuusikulmainen järjestelyihin (jos havaitaan myofibrillan poikkileikkaus).
Jokainen myosiini II -filamentti koostuu monista pakatuista myosiinimolekyyleistä, joista kukin koostuu kahdesta polypeptidiketjusta, joilla on alue tai ”pää” mazan muodossa ja jotka mahtuvat "nippuihin" filamenttien muodostamiseksi.
Molemmat kimppuja ylläpidetään niiden päiden läpi kunkin sarkomeron keskellä, niin että kunkin myosiinin "päät" on suunnattu kohti Z -linjaa, missä ohuet filamentit kiinnitetään.
Myosiinin päät täyttävät erittäin tärkeät toiminnot, koska niillä on ATP -molekyylien ammattipaikkoja ja lisäksi ne kykenevät muodostamaan ristikkäiset sillat vuorovaikutuksessa aktiinin ohuiden filamenttien kanssa.
- Liittyvät proteiinit
Aktiinifilamentit ovat "ankkuroituja" tai "kiinnitä" lihaskuitujen plasmamembraaniin (sarcolema) heidän vuorovaikutuksensa ansiosta toisen dystrofiinin proteiinin kanssa.
Lisäksi troponiinina ja tropomiosiinina tunnetaan kaksi tärkeää aktiinitonisliitosta, jotka yhdessä aktiinifilamenttien kanssa muodostavat proteiinikompleksin. Molemmat proteiinit ovat välttämättömiä vuorovaikutusten säätelemiseksi, jotka tapahtuvat ohuiden ja paksujen filamenttien välillä.
Tropomiosiini on myös kaksijakoinen filamentaarinen molekyyli, joka liittyy aktiiniin, etenee erityisesti ura -alueella, joka tapahtuu kahden säikeen välillä. Troponiini on kolmikantainen globaali proteiinikompleksi, jota on saatavana aktiinifilamentit.
Tämä viimeinen kompleksi toimii kalsiumista riippuvaisena "kytkimenä", joka säätelee lihaskuitujen supistumisprosesseja, joten se on erittäin tärkeää.
Selkärankaisten eläinten rajuutettuissa lihaksissa on lisäksi kaksi muuta proteiinia, jotka ovat vuorovaikutuksessa vastaavasti paksujen ja ohuiden filamenttien kanssa, jotka tunnetaan nimellä titinina ja nebulina.
Nebuliinilla on tärkeitä toimintoja aktiinifilamenttien pituuden säätelyssä, kun taas titinina osallistuu myosiinin filamenttien tukemiseen ja ankkurointiin sarkomeron alueella, joka tunnetaan nimellä Line M, Line M.
Muut proteiinit
On muitakin proteiineja, jotka liittyvät paksuihin myofilamenteihin, jotka tunnetaan myosiini- ja miomesiiniyhdistyksen proteiinina C, jotka ovat vastuussa myosiinin filamenttien kiinnittämisestä rivillä M.
Se voi palvella sinua: Unporto: Kuljetus kalvojen läpi, ominaisuudetFunktiot
Myofibrilleillä on alkuaineita kyvyssä liikuttaa selkärankaisia eläimiä.
Koska ne muodostavat lihaslaitteen kuitu- ja supistuvat proteiinikompleksit, nämä ovat välttämättömiä reaktioiden suorittamiseksi hermojen ärsykkeille, jotka johtavat liikkeeseen ja siirtymiseen (luurankoon nauhoitettuihin lihaksiin).
Myofibrillit, jotka sisältävät yli 40% kehon painosta, ovat luuston lihaksen kiistattomia dynaamisia ominaisuuksia, joilla on samanaikaisesti 70% ihmisen kehon proteiineista välillä 50 - 70%.
Myofibrillit, osana näitä lihaksia, osallistuvat kaikkiin toimintoihinsa:
- Mekaniikka: Kemiallisen energian muuntaminen mekaaniseksi energiaksi lujuuden tuottamiseksi, asennon ylläpitämiseksi, liikkeiden tuottamiseksi jne.
- Aineenvaihdunta-: Koska lihakset osallistuvat pohjaenergian aineenvaihduntaan ja toimii perustavanlaatuisten aineiden, kuten aminohappojen ja hiilihydraattien, varastointipaikkana; Se myötävaikuttaa myös fyysisen toiminnan tai urheiluharjoituksen aikana käytetyn energian ja hapen kulutuksen tuotantoon ja kulutukseen.
Koska myofibrillit koostuvat pääasiassa proteiineista, nämä edustavat aminohappojen varastointi- ja vapautumiskohtaa, jotka edistävät glukoosin veren tasoja paastoamisen tai nälkään aikana.
Myös näiden lihasrakenteiden aminohappojen vapauttaminen on ylittänyt muiden kudosten, kuten ihon, aivojen, sydämen ja muiden elinten biosynteettisten tarpeiden näkökulmasta.
Viitteet
- Despoulos, a., & Silbernagl, S. (2003). Fysiologian atlas (5. ed.-A. New York: Thieme.
- Friedman, a. Lens., & Goldman, ja. JA. (1996). Luurankojen myofibrillien mekaaninen karakterisointi. Biofysikaalilehti, 71(5), 2774-2785.
- Raja, w. R -., & Ochala, J. (2014). Luuston lihakset: lyhyt katsaus rakenteesta ja toiminnasta. Kalsif -kudos int, Neljä viisi(2), 183-195.
- Goldpink, G. (1970). Myofibrillien lisääntyminen lihaskuidun kasvun aikana. J -. Solu SCT., 6, 593-603.
- Murray, r., Taivutus, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harperin kuvitettu biokemia (28. ed.-A. McGraw-Hill Medical.
- Rosen, J. N., & Baylies, M. K -k -. (2017). Myofibrillit laittavat puristuksen ytimiin. Luonnonsolubiologia, 19(10).
- Sanger, J., Wangs, J., Tuuletin ja., Valkoinen, J., Mi-my, l., Dube, D.,... Pruyne, D. (2016). Myofibrillien kokoaminen ja ylläpito striadin lihaksessa. Sisään Kokeellisen farmakologian käsikirja (p. 37). New York, USA: Springer International Publishing Sveitsi.
- Sanger, J. W -., Wang, J., Tuuletin ja., Valkoinen, J., & Sanger, J. M. (2010). Myofibrillien kokoonpano ja dynamiikka. Biolääketiede ja bioteknologia, 2010, 8.
- Sobieszek, a., & Bremel, R. (1975). Selkärankaisten sileän lihas myofibrillien ja aktomyosiinin valmistus ja ominaisuudet. European Journal of Biokemia, 55(1), 49-60.
- Villi, c., Walker, W., & Smith, f. (1963). Yleinen eläintiede (2. painos.-A. Lontoo: W. B -. Saunders Company.
- « Lobelia -ominaisuudet, elinympäristö, jakautuminen, lajit
- Ominaisuudet kefalopodit, elinympäristö, lisääntyminen, ravitsemus »

