Myofilamenttityypit, rakenne ja organisaatio
- 1881
- 359
- Kelly Kilback
Se Myofilamentit Ne ovat myofibrillien supistuvia proteiineja, jotka ovat lihassolujen rakenneyksiköitä, pitkänomaisia soluja, joita kutsutaan lihaskuiduiksi.
Lihaskuiduilla ja niiden komponenteilla on erityiset nimet. Esimerkiksi membraani, sytoplasma, mitokondriot ja endoplasminen retikulum tunnetaan sarkolema, sarkoplasma, sarkosoomat ja sarkoplasminen retikulum, vastaavasti.
 Myofilaments -rakenne (lähde: Mikael Häggström, käytetty luvan kanssa. [Julkinen alue] Wikimedia Commonsin kautta)
Myofilaments -rakenne (lähde: Mikael Häggström, käytetty luvan kanssa. [Julkinen alue] Wikimedia Commonsin kautta) Samoin sisäpuolella olevia supistuvia elementtejä kutsutaan myofibrilliksi yhdessä; ja myofibrillien muodostavia supistuvia proteiineja kutsutaan myofilamenteiksi.
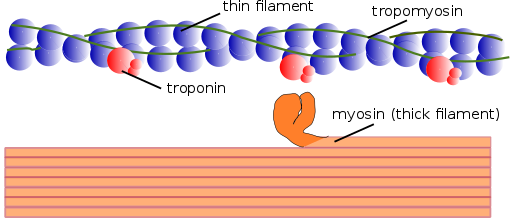
Myofilamentteja on kahta tyyppiä: ohut ja paksuus. Ohut filamentit koostuvat pääasiassa kolmesta proteiinista: aktiini F, tropomiosiini ja troponiini. Sillä välin paksut filamentit koostuvat vain toisesta proteiinista, joka tunnetaan nimellä Myosina II.
Näiden lisäksi on olemassa muitakin proteiineja, jotka liittyvät sekä paksuihin että ohuksiin filamenteihin, mutta näillä ei ole supistuvia toimintoja, ellei pikemmin.
[TOC]
Lihaskuitujen tyypit
Myofibrillit muodostavien myofilamenttien erityinen sijoitus aiheuttaa kahden tyyppisiä lihaskuituja: nauhoitettuja lihaskuituja ja sileitä lihaskuituja.
Kannatut lihaskuidut tutkiessaan optista mikroskooppia, osoittavat strierics- tai poikittaisinauhojen kuvion, joka toistetaan sen koko pinnalla ja jotka antavat nimen, lihakset, jotka sisältävät ne, nauhoitetut lihakset. Strnety -lihaskuituja, luurankoa ja sydämen tyyppejä on kahta tyyppiä.
Lihaskuidut, jotka eivät osoita, että ristiyhnaisten mallia kutsutaan sileiksi kuiduiksi. Ne ovat ne, jotka muodostavat verisuonien seinien ja sisäelimen lihaksen.
Rakenne
Ohut myofilamentit
Nämä myofilamentit koostuvat aktiinista F ja kahdesta niihin liittyvästä proteiinista: tropomiosiini ja troponiini, joilla on säätelytoiminnot.
Aktiini F tai rihmamainen aktiini on polymeeri toisesta pienemmästä globaalista proteiinista, jota kutsutaan aktiiniksi g tai globaaliksi aktiiniksi, noin 42 kDa molekyylipainosta. Siinä on myosiinin ammattiliitto, ja sen on määrätty muodostamaan kaksi ketjua, jotka on järjestetty kaksoispotkuriksi, joka koostuu noin 13 monomeeristä käännöstä.
Se voi palvella sinua: Proteolyysi: Tyypit ja toiminnotAktiini -f -filamenteille on ominaista, että sillä on kaksi napaa: yksi positiivinen, kohdistettu Disc Z: lle ja toinen negatiivinen, järjestetty kohti sarkomeron keskustaa.
Tropomiosiini koostuu myös kaksinkertaisesta potkurin polypeptidiketjusta. Se on 64 kDa.
Lepolla tropomiosiini kattaa tai "kansi" aktiinin unionin kohteet myosiinille, estäen molempien proteiinien vuorovaikutuksen, mikä aiheuttaa lihaksen supistumisen. Jokaisen ohuen filamentin ympärillä ja noin 25 tai 30ηm kunkin tropomiosiinin alusta on toinen proteiini, nimeltään troponiini.
Troponiini (TN) on proteiinikompleksi, joka koostuu kolmesta globaalien polypeptidien alayksiköstä, joita kutsutaan troponiiniksi T, C ja I. Jokaisella tropomiosiinimolekyylillä on siihen liittyvä troponiinikompleksi, joka säätelee sitä, ja yhdessä ne ovat vastuussa lihasten supistumisen alun ja loppuun saattamisesta.
Paksut myofilamentit
Paksut filamentit ovat myosiini II -polymeerejä, jotka painaavat 510 kDa ja muodostetaan kahdella raskaalla ketjulla 222 kDa ja neljä valoketjua. Kevyet ketjut ovat kahta tyyppiä: välttämättömät valoketjut, 18 kDa ja 22 kDa: n sääntelyketjut.
Jokaisessa Myosina II -ketjussa on sokeriruo'on muoto, jonka päässä on pieni palloinen pää, joka projisoidaan melkein 90⁰ ja jolla on kaksi kiinnityspaikkaa, toinen aktiinille ja toinen ATP: lle. Siksi nämä proteiinit kuuluvat Atasas -perheeseen.
Paksu filamentti koostuu yli 200 myosiini II -molekyylistä. Kunkin näiden molekyylien palloinen pää toimii "soutuksena" supistumisen aikana, työntäen aktiinia, johon se on kytketty siten, että se liukuu kohti sarkomeron keskustaa.
Organisaatio
Luurankojen lihaskuidussa myofibrillit miehittävät suurimman osan sarkoplasmasta, ja ne on järjestetty pitkittäisissä ja järjestetyissä sarjoissa koko solussa.
Voi palvella sinua: mitokondriatOptisella mikroskoopilla näkyvällä pitkittäisellä leikkauksella kevyet nauhat, nimeltään Bands I ja Dark Bands, nimeltään Bands A Bands, havaitaan. Nämä kaistat vastaavat myofibrillien järjestämistä ja siten niiden muodostavien myofilamenttien jakamista.
Bändin keskellä I on tumma ja ohut viiva, nimeltään Line tai Disc z. Kunkin bändin A keskusta esittelee selkeämmän alueen, joka tunnetaan nimellä Band H, joka on keskitetysti jaettu tummemmalla viivalla, nimeltään M Line.
Kahden z -viivan välissä on kuvattu rakenne, nimeltään sarkomeeri, joka on luuston lihaksen funktionaalinen yksikkö. Sarkomaari koostuu supistuvista myofilamenteista, jotka on järjestetty kaistaleissa A, H ja Hemi-kaista I Kummassa päässä.
Nauhat I sisältävät vain ohuita filamentteja, nauha sisältää paksut filamentit, jotka on kietoutunut niiden kahteen päähän hienoilla filamenteilla ja nauha H sisältää vain paksuja filamentteja.
Kuinka myofilamentit järjestetään sarkomeerien sisällä?
Sekä paksut myofilamentit että ohuet myofilamentit voidaan havaita tutkittaessa luurankojen lihasnäyte elektronisella mikroskoopilla. Sanotaan.
Ohut filamentit ovat peräisin Z -levyistä ja ulottuvat molemmille puolille vastakkaiseen suuntaan ja kohti kunkin viereisen sarkomeerin keskustaa. Sarkomeron kummassakin päässä olevista Z -levyistä, rento lihaksessa, aktiini saavuttaa bändin H alun molemmilla puolilla.
Siten luuston lihaksen lihaskuiduissa rento paksu myofilamentit miehittävät keskialueen, joka muodostaa tummat nauhat tai nauhat A; Ja ohuet filamentit ulottuvat sarkomeerin molemmille puolille saavuttamatta sen keskustaan.
Risti -asemassa alueella, jolla paksut ja ohuet filamentit ovat päällekkäisiä, voidaan havaita kuusikulmainen kuvio, joka sisältää keskellä olevan paksun filamentin ja kuusi ohutta filamenttia, jotka sitä ympäröivät ja jotka sijaitsevat jokaisessa kuusikulmion reunassa kuusikulmio.
Voi palvella sinua: Simplasto: Osat ja ominaisuudetTämä myofilamenttien organisaatio sarkomeerissä säilyy myofilamenteihin liittyvän proteiinisarjan toiminnalla ja joilla on rakennefunktioita, joista titiini, alfa -aktiini, nebuliini, miomesiini ja proteiini C voidaan korostaa.
Supistumismekanismi
Kun asetyylikoliini (neurotransmitter) vapautuu neuromuskulaarisessa levyllä motorisen neuronin stimulaation vuoksi, lihaskuitu on innostunut ja sarkoplasmisten retikulosten jännitteestä riippuvat kalsiumkanavat avataan.
Kalsium sitoutuu troponiiniin C, ja tämä aiheuttaa konformaatiomuutoksen tropomiosiinissa, joka paljastaa aktiiviset kohdat, siten supistumisen aloittamisen. Kun kalsiumtasot laskevat, tropomiosiini palaa alkuperäiseen sijaintiinsa ja supistuminen lakkaa.
Aktiinin unionin sivustojen altistuminen myosiinin kanssa antaa molemmille proteiineille liittyä ja että myosiini työntää aktiinia kohti sarkomeerin keskustaa, liu'uttaen myosiinin yli.
Lihasten supistumisen aikana kunkin sarkomeerin z -linjat lähestyvät keskustaa, lähestyen linjaa M. Lyhennysaste riippuu supistuneen lihaksen jokaisen saromin lyhentymisen summasta.
Viitteet
- Berne, r., & Levy, M. (1990). Fysiologia. Mosby; Kansainvälinen painos.
- Kettu, s. Yllyttää. (2006). Ihmisen fysiologia (9. painos.-A. New York, USA: McGraw-Hill Press.
- Gartner, L., & Hiatt, J. (2002). Histologian atlas -teksti (2. painos.-A. Meksiko d.F.: McGraw-Hill-Amerikanväliset toimittajat.
- Murray, r., Taivutus, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harperin havainnollistettu biokemia (28. ed.-A. McGraw-Hill Medical.
- Rawn, j. D -d. (1998). Biokemia. Burlington, Massachusetts: Neil Patterson Publishers.
- Ross, m., & Pawlina, W. (2006). Histologia. Teksti ja atlas korreloivan solun ja molekyylibiologian kanssa (5. ed.-A. Lippinott Williams & Wilkins.
- West, J. (1998). Lääketieteellisen käytännön fysiologinen perusta (12ava ed.-A. Meksiko d.F.: Pan -American Medical Editorial.
- « Promielocito -ominaisuudet, toiminnot ja patologiat
- Kirahvi -ominaisuudet, elinympäristö, lisääntyminen, ruoka »

