Nykyinen atomimalli

- 2109
- 348
- Gabriel Fahey
Mikä on nykyinen atomimalli?
Hän Nykyinen atomimalli Se perustuu kvanttimekaniikkaan, etenkin Schrödinger -yhtälössä, Paulin syrjäytymisen periaatteessa ja nimeltään elektronin ominaisuus pyöriä jompikumpi Tarkkailla.
Se on malli suurimmasta hyväksynnästä ja käytöstä atomien, molekyylien rakenteen ja elementtien kemiallisen reaktiivisuuden tutkimuksessa niiden ennusteiden tarkkuuden ja niiden suhteellisen yksinkertaisuuden vuoksi.
 Kuvio 1. Vetyatomi viritetyssä tilassa ja sen atomilukuissa: energia n = 4, kulma momentti L = 3 ja magneettinen momentti M = 1. Lähde: Wikimedia Commons.
Kuvio 1. Vetyatomi viritetyssä tilassa ja sen atomilukuissa: energia n = 4, kulma momentti L = 3 ja magneettinen momentti M = 1. Lähde: Wikimedia Commons. Tämä malli on useiden aiempien atomimallien, kuten Rutherford -mallin ja Bohr - Sommerfeldin, kehitys, jota pidetään klassisena tai puoliklassisena mallin mukaan.
Tällä hetkellä on teoreettisesti täydellisempiä malleja kuin Schrödingerin tyypillinen malli, kuten Dirac-Jordan-malli, joka sisältää erityisen relatiivisuuden ja perustuu Dirac-aaltoyhtälöön. Tässä yhtälössä spin, alussa mainittujen elektronien ominaisuus ilmestyy luonnollisesti.
On myös malleja, jotka perustuvat kvanttikenttäteoriaan, jota sovelletaan korkean energian fysiikassa. Nämä mallit ovat erinomaisia ennustaessaan perushiukkasten luomista ja tuhoamista, tämän fysiikan alan tavoitetta.
On syytä mainita, että hienostuneimmat teoriat lähentyvät samoihin tuloksiin kuin Schrödinger -yhtälön, etenkin kevyiden atomien suhteen.
Nykyiset atomimalliominaisuudet
Nykyisen atomin visiossa, joka perustuu ei-relativistiseen kvantiin, planeettajärjestelmien tyyliin ei ole käsitettä sähköisiä kiertoratoja.
Atomin laajin kuva on kuitenkin edelleen positiivinen keskusydin ja jotkut negatiiviset sähkövarauspisteet (elektronit), jotka kääntyvät täydellisesti määriteltyihin kiertorauhaan keskusytimen ympärille. Mutta juuristaan huolimatta se ei enää vastaa nykyistä atomimallia.
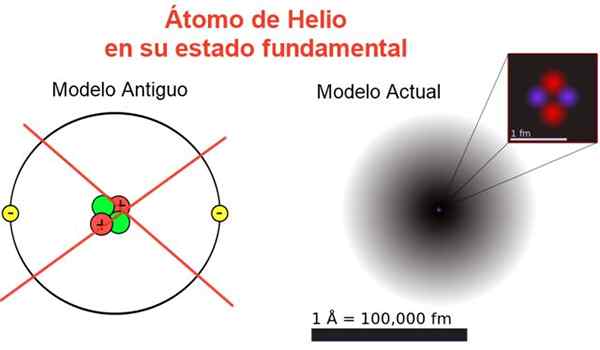 Kuva 2. Klassinen ja nykyinen kuva helium -atomista sen perustilassa. Nykyisessä mallissa helium -atomin kaksi elektronia ovat hajallaan alueelle, jota kutsutaan kiertoradaksi. Lähde: Wikimedia Commons, oma sävellys.
Kuva 2. Klassinen ja nykyinen kuva helium -atomista sen perustilassa. Nykyisessä mallissa helium -atomin kaksi elektronia ovat hajallaan alueelle, jota kutsutaan kiertoradaksi. Lähde: Wikimedia Commons, oma sävellys. Kuvio 2 näyttää vanhan kuvan ja heliumiatomin nykyisen kuvan pienemmässä energiatilassa (taso n = 1 ja l = 0).
Se voi palvella sinua: keskimääräinen kiihtyvyys: miten se lasketaan ja ratkaistaanKlassinen kuva on hyödyllinen nähdä, että ydin sisältää kaksi protonia ja kaksi neutronia. Atomin neutraalisuuden takaaminen Kaksi elektronia, jotka miehittävät samalla energiatasolla.
Lopusta se on kuva, joka on kaukana todellisuudesta, koska ytimen asteikko ei edes vastaa atomin kokoa: ydin on 1/100000 kertaa atomin koko, mutta siinä atomimassa on keskittynyt.
Onda -kaksinaisuus - hiukkas
Klassinen mekaniikka osoittaa, että jokaisella materiaalihiukkasella on siihen liittyvä aalto, nimeltään Aaltofunktio. Tämä on kuuluisa Onda-Particle-kaksinaisuus Louis de Brogliesta.
Nykyisessä atomimallissa elektronin käyttäytyminen atomien mittakaavassa on näkyvästi aaltoileva, kun taas makroskooppisella tasolla, kuten elektronit, jotka liikkuvat vanhojen televisioiden katodisäteputkissa, korpuskulaarinen käyttäytyminen pääasiassa.
Toisaalta fotonien kanssa se tapahtuu päinvastoin, useimmissa optisissa ilmiöissä (makroskooppisella tasolla) heillä on pohjimmiltaan aaltoileva käyttäytyminen. Ja kun he ovat vuorovaikutuksessa aineen asioiden kanssa, heillä on hiukkasten käyttäytyminen.
Tämän vuoksi ytimen ympärillä olevat elektronit ovat hajallaan alueille, joita kutsutaan atomi -orbitaalit, joiden muoto ja laajennus riippuvat elektronien energiatasosta ja kulmavallasta.
Sekä energialla että ytimen ympärillä olevan elektronin kulmavirheellä on tiettyjä sallittuja arvoja, joten sanotaan, että ne ovat kvantisoitu.
Schrödinger -aaltoyhtälö ennustaa, mitkä energia -arvot ja kulmavirta ovat sallittuja, samoin kuin jokaiseen energia- ja vauhtitasoon liittyvä aaltofunktio.
Aaltofunktion matemaattinen neliö määrittää kiertoradan, toisin sanoen ytimen ympärillä olevat alueet, joilla elektroneja voidaan löytää todennäköisemmin.
Atomin koko
Kuvittelemme, että atomilla on halkaisija, kuten nykyisestä atomismallista. Ydin olisi kuin muurahainen kentän keskellä, mutta yllättäen 99,9% atomimassasta.
Toisaalta elektronit olisivat yhtä hajaamaisia aavemaisia pelaajia koko kentällä, ja todennäköisyys on keskikenttäkenttä.
Voi palvella sinua: kategorinen muuttuja: Ominaisuudet ja esimerkitOn olemassa muutamia suuntauksia tai sallittuja tapoja miehittää kenttä, joka riippuu pelaajien (elektronien) energiasta ja ”käännöksen” tai pyörittämisestä keskuksen ympärillä.
Nykyinen atomimalli postuloi
1.- Elektronille on ominaista massa m, sen kehruu s Ja olla alkuaine-negatiivinen kuormituskantajan hiukkas (-e).
2.- Elektroneilla on kaksinkertainen, aallonmuotoinen käyttäytyminen, mutta niiden energiasta ja ilmiön mittakaavasta riippuen voivat olla entistä enemmän kuin toisia.
3.- Elektronit ympäröivät positiivista atomiydintä siten, että ne takaavat atomin sähköisen neutraalisuuden. Siksi elektronien määrä on yhtä suuri kuin protonien määrä; Tämä on atominumero, joka antaa kunkin elementin kemialliset ja fysikaaliset ominaisuudet.
4.- Elektronien ja ytimen välinen vuorovaikutus on mallinnettu potentiaalisella V: llä (r -) Coulombin sähköstaattinen, joka sisällytetään termipotentiaalienergiaan Hamiltonin operaattoriin.
5.- Hamiltonin operaattorin kineettisen energian termi on operaattori, joka on rakennettu lineaarisesta vauhti -operaattorista, joka on sama:
p = - i ħ ∂ /∂r -
Missä ħ on Planckin vakio jaettuna 2π: llä.
6.- Hamiltonian operaattori H = (P⋅p)/2M - E V (r -) toimia elektroniaaltofunktiossa ψ (r --A.
7.- Koska elektronisen aaltofunktion paikallaan olevat ratkaisut haetaan, käytetään riippumatonta Schrödinger -yhtälöä:
H ψ (r -) = E ψ (r --A
Missä E edustaa elektronin kokonaisenergiaa.
8.- Atomeissa, joissa on useita elektroneja, niiden välistä vuorovaikutusta ei oteta huomioon.
9.- Monien elektronien atomien suhteen uloimpien elektronien orbitaalit mallinntaan suojatun ytimen potentiaalilla, joka tunnetaan nimellä Debye -potentiaali.
10.- Yhtälöllä (7) on ratkaisu joillekin erillisille energia -arvoille, niin että kuuluisuudet Kuinka monta Planckista, Ne esiintyvät luonnollisesti Schrödingerin yhtälöratkaisuista.
Se voi palvella sinua: paikallaan olevat aallot: kaavat, ominaisuudet, tyypit, esimerkityksitoista.- Jokaiselle erilliselle arvolle on aaltofunktio. Mutta jotkut ratkaisut ovat rappeutuneet kulman momentin arvosta riippuen.
12.- Aaltofunktio on säteittäisen funktion, atsimutaalinen funktio ja polaarinen funktio.
13.- Tämä aaltofunktio määrittää elektronin sallitut alueet. Aaltofunktion neliö on todennäköisyystiheys Elektronin löytäminen tietyssä asennossa, nähty atomien ytimen keskustasta.
14.- Spin ei näy Schrödinger -yhtälössä, vaan se on sisällytetty atomimalliin Paulin periaatteen kautta:
Elektroni on fermion, jossa on kaksi mahdollista Spin +½ ja -½ -tilaa.
Joten samalle tilalle, jolle on ominaista Schrödinger -yhtälön kvantinumerot n, l, m, voidaan käyttää korkeintaan 2 elektronia vastakohtien kanssa vastakohdista vastakkaisia vastakohtia. Tällä tavoin Espin tulee neljäs kvanttiluku.
Vaikuttavat tutkijat nykyisessä atomimallissa
Vaikuttaa uskomattomalta, mutta suurin osa fyysikoista, jotka osallistuivat nykyiseen atomimalliin. He kokoontuivat kuuluisiin konferensseihin, joita sponsoroi Belgian alkuperän kemisti ja teollisuus, joka tuli kuuluisaksi tiedemaailmassa.
Ne alkoivat pitää vuodesta 1911 lähtien ja yhdistivät hetken suurimmat tutkijat, heidän joukossaan olivat käytännössä kaikki ne, jotka antoivat panoksensa nykyiseen atomimalliin.
Näistä konferensseista tunnetuin pidettiin Brysselissä vuonna 1927, ja siellä tämä historiallinen valokuva otettiin:
 Kuva 3. 1927 Solvay -konferenssin osallistujat Brysselissä. Lähde: Wikimedia Commons.
Kuva 3. 1927 Solvay -konferenssin osallistujat Brysselissä. Lähde: Wikimedia Commons.  Kuva 4. Solvay 1927 -konferenssin osallistujat.
Kuva 4. Solvay 1927 -konferenssin osallistujat. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antona Lorentz
- Lempeä
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Temile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-eugène guye
- Wolfgang Pauli
- Werner Heisenberg
- Max syntynyt
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels Bohr
- Owen Williams Richardson
Kiinnostavia artikkeleita
Schrödinger Atomic -malli.
Broglie -atomimalli.
Chadwick Atomic -malli.
Heisenberg Atomic -malli.
Perrin Atomic -malli.
Thomson Atomic -malli.
Dalton Atomic -malli.
Dirac Jordan Atomic -malli.
Democritus Atomic -malli.
Leucpo -atomimalli.
Bohr -atomimalli.
Viitteet
- Alonso - Finn. Kvantti- ja tilastolliset perusteet. Addison Wesley.
- Bauer, W. 2011. Fysiikka tekniikkaan ja tieteisiin. Osa 1. MC Graw Hill.
- Eisberg ja Resnick. Kvanttifysiikka. Limusa - Wiley.
- Wikipedia. Atomiteoria. Palautettu: on.Wikipedia.com
- Zapata f. Tyypillinen atomin malli. Haettu: Lifer.com

