Bohr -atomimalli

- 2949
- 883
- Gabriel Fahey
Hän Bohr -atomimalli Se on tanskalaisen fyysikon Niels Bohrin (1885-1962) käsitys atomin rakenteesta, julkaistu vuonna 1913. Bohr -atomisessa ytimen ympärillä olevat elektronit miehittävät vain tietyt sallitut kiertoradat nimeltään rajoituksen ansiosta kvantisointi.
Bohrille, atomin kuva pienikokoisena aurinkojärjestelmänä, elektronien kanssa kiertämällä ytimen ympärillä, se ei ollut täysin yhdenmukaista sen tosiasian kanssa, että sähköiset varaukset, kun ne kiihdytetään, säteilevät energiaa energiaa.

Tällainen atomi ei olisi vakaa, koska se loppuu romahtamiseen ennemmin tai myöhemmin, koska elektronit saostaisivat spiraalisesti ytimeen. Ja siihen mennessä 50 vuotta sitten tyypilliset valokuviot, jotka säteilevät vetyä ja muita kaasuja lämmittäessä.
Kuvio tai spektri koostuu sarjasta kirkkaita viivoja, joilla on tiettyjä erityisiä aallonpituuksia. Ja vetyatomi ei romahtaa lähettämällä valoa.
Selittääksesi, miksi atomi on vakaa huolimatta siitä, että se pystyy säteilemään sähkömagneettista energiaa, Bohr ehdotti, että kulmavirta voisi käyttää vain tiettyjä arvoja, ja siksi myös energia. Tätä ymmärretään kvantisoinnilla.
Hyväksyessään, että energia oli kvantisoitu, elektronilla olisi tarvittava stabiilisuus olla kiirehtiä kohti ytimtä, joka tuhoaa atomin.
Ja atomi säteilee vain kevyttä energiaa, kun elektroni muuttuu kiertoradalta toiseen, aina erillisinä määrinä. Tällä tavoin selitetään päästökuvioiden läsnäolo vedyssä.
Bohr koostuu tällä tavalla visio atomista, joka integroi klassisen mekaniikan tunnettuja käsitteitä vasta löydettyihin, kuten Planckin vakio, fotoni, elektroni, atomiydin (Rutherford oli ollut Bohrin mentori) ja edellä mainitussa SPECTRA: n mentorissa) ja edellä.
[TOC]
Bohr -mallin pääominaisuudet
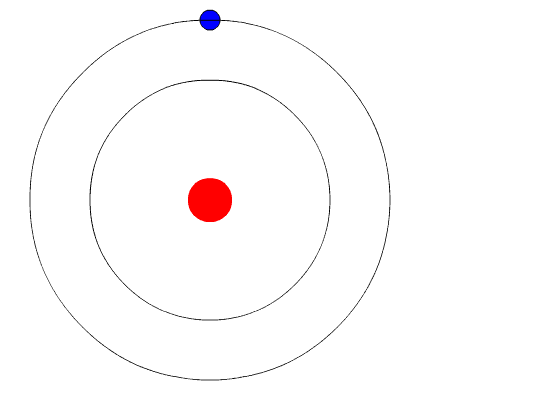 Bohrin atomi. Animaatio edustaa elektronia, kun se siirtyy korkeammalta energiatasolta toiseen vähemmän energiaa, säteilemällä valon valoa (fotonia). Lähde: Wikimedia Commons.
Bohrin atomi. Animaatio edustaa elektronia, kun se siirtyy korkeammalta energiatasolta toiseen vähemmän energiaa, säteilemällä valon valoa (fotonia). Lähde: Wikimedia Commons. Bohrin atomimalli olettaa, että elektroni liikkuu ytimen ympärillä olevalla pyöreällä kiertoradalla Coulombin sähköstaattisen vetovoiman vaikutuksesta ja ehdottaa, että elektronin kulmavirta on kvantisoitu.
Voi palvella sinua: tasapainotusvektori: Laskenta, esimerkit, harjoituksetKatsotaanpa kuinka integroida molemmat käsitteet matemaattisessa muodossa:
Olkoon l kulman momentin suuruus, m elektronin massa ja elektronin nopeus ja r kiertoradan säde. L: n laskemiseksi meillä on:
L = m⋅r⋅V
Bohr ehdotti, että L oli yhtä suuri kuin vakio H/2π -monikerrokset, joissa H on Planck Constant, Fyysikko Max Planck (1858-1947) esitteli lyhyen aikaa sitten mustan rungon lähettämän energia-ongelman ratkaisemiseksi, teoreettinen esine, joka absorboi kaiken tapahtuvan valon.
Sen arvo on H = 6.626 × 10−34 J ・ s, kun h/2π on merkitty ħ, Se lukee "H Bar".
Siksi kulmavirhe L pysyy:
m⋅r⋅V = nħ, N = 1,2, 3 ..
Ja tästä tilasta elektronille sallittujen kiertoratojen radiot johdetaan, kuten näemme.
Elektronien kiertoradan säteen laskenta
Seuraavassa oletamme yksinkertaisimman atomien: vety, joka koostuu yhdestä protonista ja elektronista, molemmat suuruuskuormituksella ja.
Centripetaalivoima, joka pitää elektronin pyöreällä kiertoradalla, saadaan sähköstaattinen vetovoima, jonka suuruus f on:
F = ke2/r2
Missä k on Coulombin ja R-lain sähköstaattinen vakio, elektroni-proteiinin etäisyys. Tietäen, että ympyränmuotoisessa liikkeessä centripetaalin kiihtyvyysc Se on annettu syynä nopeuden ja etäisyyden r: n välillä:
-llac = v2 / r
Newtonin toinen laki, nettovoima on Mass M: n tuote kiihtyvyydellä:
MV2/r = ke2/r2
Radio R: n yksinkertaistaminen saadaan:
Möv2R = ke2
Yhdistämällä tämä lauseke kulmavirran lausekkeeseen, meillä on yhtälöjärjestelmä, jonka on antanut:
Se voi palvella sinua: Fyysinen etenemissuunta: Ominaisuudet, tyypit, esimerkit ja harjoitukset1) MV2R = ke2
2) r = n ħ/MV
Ajatuksena on ratkaista järjestelmä ja määrittää r, sallitun kiertoradan säde. Pieni algebra johtaa vastaukseen:
R = (nħ-A2 / K⋅m⋅e2
N = 1, 2, 3, 4, 5 ..
N = 1 meillä on vähiten radioista, nimeltään Bohr Radio ajompikumpi Arvolla 0,529 × 10−10 m. Muiden kiertoratojen radiot ilmaistaan -llajompikumpi.
Tällä tavoin Bohr esittelee päämäärän lukumäärän n, huomauttaen, että sallitut radiot perustuvat Planck -vakioon, sähköstaattiseen vakioon sekä elektronin massaan ja kuormaan.
Bohr -atomimalli postuloi
 Tanskan fyysikko Niels Bohr (1885-1962).
Tanskan fyysikko Niels Bohr (1885-1962). Bohr yhdistää taitavasti Newtonin mekaniikan uusiin löytöihin, jotka olivat jatkuvasti antaneet 1800 -luvun jälkipuoliskolla ja 1900 -luvun alkupuolella. Heidän joukossaan vallankumouksellinen käsite "kuinka paljon", josta Planck itse väitti olevan kovin vakuuttunut.
Teoriansa kautta Bohr pystyi tyydyttävästi selittämään vetypektrin sarjan ja ennustamaan energiapäästöjä ultravioletin ja infrapunan luokituksessa, jota ei vielä ollut havaittu.
Voimme tiivistää postulaatit seuraavasti:
Elektronit kuvaavat pyöreitä ratoja
Elektroni pyörii ytimen ympärillä stabiililla pyöreällä kiertoradalla, tasaisella pyöreällä liikkeellä. Liike johtuu sähköstaattisesta vetovoimasta, jota ydin käyttää siihen.
Kulmainen vauhti on kvantisoitu
Elektronin kulmavirta kvantisoituu lausekkeen mukaan:
L = mvr = nħ
Missä n on kokonaisluku: n = 1, 2, 3, 4 ..., mikä johtaa elektroniin, voi olla vain tietyillä määriteltyillä kiertoradalla, joiden radiot ovat:
R = (n ħ-A2 / k m e2
Elektronit lähettävät tai absorboivat fotoneja, kun ne siirtyvät energiatilasta toiseen
 Kun siirrytään energiatilasta toiseen, elektroni absorboi tai emittoi energiaa erillisissä määrissä, nimeltään fotonit. Lähde: Wikimedia Commons.
Kun siirrytään energiatilasta toiseen, elektroni absorboi tai emittoi energiaa erillisissä määrissä, nimeltään fotonit. Lähde: Wikimedia Commons. Koska kulmavirta on kvantisoitu, energia ja myös. Voidaan osoittaa, että E: lle annetaan:
Voi palvella sinua: Pystysuora laukaus: Kaavat, yhtälöt, esimerkit
Volti -elektroni tai EV on toinen energiayksikkö, jota käytetään laajasti atomifysiikassa. Energian negatiivinen merkki varmistaa kiertoradan vakauden, mikä osoittaa, että elektronin erottamiseksi tästä sijainnista on tehtävä työtä.
Kun elektroni on kiertoradallaan, ei absorboi tai säteilee valoa. Mutta kun se hyppää suuremman energian kiertoradalta pienemmälle.
Säilytetyn valon taajuus F riippuu kiertoratojen energiatasojen eroista:
E = hf = ealkukirjain - Elopullinen
Rajoitukset
Bohr -mallilla on tiettyjä rajoituksia:
-Se koskee vain vetyatomia. Yritykset soveltaa sitä monimutkaisempiin atomeihin eivät toimineet.
-Se ei vastaa miksi jotkut kiertoradat ovat vakaita, toiset eivät. Se tosiasia, että atomin energia kvantisoitiin, toimi erittäin hyvin, mutta malli ei antanut syytä, ja se oli jotain, joka aiheutti epämukavuutta tutkijoille.
-Toinen tärkeä rajoitus on, että se ei selittänyt atomien myöntämiä lisälinjoja sähkömagneettisten kenttien läsnä ollessa (Zeeman Effect ja Stark Effect). Tai miksi jotkut spektrin linjat olivat voimakkaampia kuin toiset.
-Bohr -malli ei ota huomioon relativistisia vaikutuksia, mikä on välttämätöntä.
-On itsestään selvää, että on mahdollista tietää tarkalleen elektronin sijainti ja nopeus, mutta mikä todella lasketaan, on todennäköisyys, että elektroni vie tietyn aseman.
Rajoituksistaan huolimatta mallilla oli tuolloin suuri menestys paitsi uusien löytöjen integroimiseksi jo tunnetuihin elementteihin, vaan koska se osoitti uusia kysymyksiä, mikä teki selväksi, että polku atomin tyydyttävään selitykseen oli kvanttimekaniikassa.
Kiinnostavia artikkeleita
Schrödinger Atomic -malli.
Broglie -atomimalli.
Chadwick Atomic -malli.
Heisenberg Atomic -malli.
Perrin Atomic -malli.
Thomson Atomic -malli.
Dalton Atomic -malli.
Dirac Jordan Atomic -malli.
Democritus Atomic -malli.
Leucpo -atomimalli.
Sommerfeld Atom -malli.
Nykyinen atomimalli.


