Posteeral muutokset
- 1724
- 54
- Arthur Terry II
Mitkä ovat translaation jälkeiset muutokset?
Translaation jälkeiset muutokset ovat palautuvia tai peruuttamattomia modifikaatioita tai kemiallisia muutoksia.
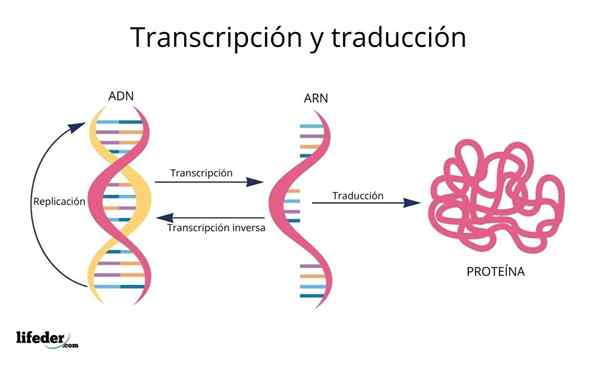
Käännös on seurausta eukaryoottisesta ytimestä löytyvien geenien "lukemisesta ja tulkinnasta" (esiintyy myös prokaryooteissa).
Solun geenisarja -perimä- Siellä ohjeiden on tuottaa kaikki rakenneproteiinit ja entsyymit, joita löytyy solun sisäpuolelta, joilla kunkin solun prosessit ja elintärkeät toiminnot ovat riippuvaisia.
Geenit muodostuvat DNA: n (deoksihaponhappo) avulla, joka on makromolekyyli, joka on muodostettu kahdella komplementaarisella ketjulla polymeeristä, jotka koostuvat 4 tyypistä erilaisista molekyyleistä, joita kutsutaan typpipohjat, Nimittäin: Adenina, Timina, Guanina ja sytosiini.
DNA on siis eräänlainen aakkoset Tiedoilla, jotka luetaan ja käännetään.
Ennen käännöstä DNA: n tiedot ovat ensin kirjoitettu Ytimessä toiseen hyvin samanlaiseen molekyyliin, RNA (ribonukleiinihappo), kutsuttujen molekyylien muodossa Messenger -RNA, jotka myöhemmin kuljetetaan sytosoliin.
RNA on hyvin samanlainen kuin DNA, mutta se muodostuu yhdellä ketjulla, joka koostuu adeniini-, urasiili-, guaniini- ja sytosiinin typpipohjista.
Geneettisistä koodaavista proteiinisekvensseistä johdetut Messenger -RNA: t "luetaan" ja niiden sekvenssi on käännetty Soluproteiinien peptidisekvensseissä ribosomien ja muiden nimellä tunnetuiden RNA -molekyylien avulla Siirto -RNA Se, kuten nimi viittaa, He siirtyvät syntetisoidulle proteiinille sopivat aminohapot.
Järjestys, jossa nämä aminohapot lisätään syntyviin proteiineihin.
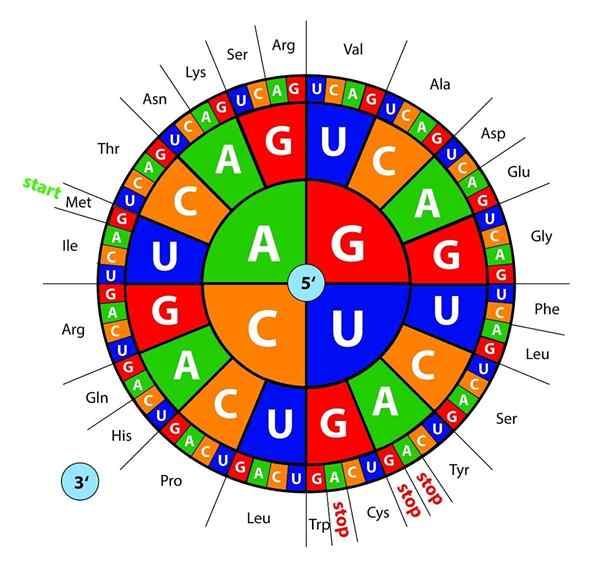
RNA: ksi transkriptoituja DNA -emäksiä "luetaan" ribosomeilla triosissa tai kolmoisina nimeltään koodonit, Jokainen näistä koodaa yhdelle 20 aminohapposta, joiden kanssa proteiinit muodostuvat; Tässä on tämä geneettinen koodi tulkitaan ottamaan käyttöön oikeassa järjestyksessä aminohappo samanaikaisesti.
Translaation jälkeiset muutokset
Suurin osa kunkin proteiinin fysikaalis -kemiallisista ja toiminnallisista ominaisuuksista riippuu pääasiassa DNA: ssa koodattuista tiedoista.
Solut onnistuvat kuitenkin lisäämään merkittävästi niiden proteiinien monimuotoisuutta translaation jälkeisillä modifikaatioilla, jotka eivät ole muuta kuin kemiallisia modifikaatioita - entsyymien välittämiä -, jotka kärsivät joitain proteiineja niiden translaation jälkeen.
Se voi palvella sinua: oksidaasiglukoosi: Ominaisuudet, rakenne, toiminnotSiksi joidenkin proteiinien ominaisuuksia ei voida päätellä yksinomaan aminohapposekvenssistä, joka johtuu geneettisestä tiedoista.
Nämä modifikaatiot tapahtuvat yleensä aminohappojätteissä, jotka tekevät.
Yli 500 post -translaation modifikaatiota on kuvattu, mutta näistä tunnetuimmista ja tutkituista ovat fosforylaatio, disulfidisiltojen muodostuminen, metylaatio, asetylointi, hydroksylaatio, glykosylaatio, prenilaatio, ubikvitinointi ja karboksilointi.
Postradional -modifiointiprosessi
Kuten olemme kommentoineet, jälkeiset translaation modifikaatiot ovat kemiallisia modifikaatioita, jotka kärsivät eukaryoottisoluproteiineista niiden synteesin jälkeen, toisin sanoen niiden translaatio.
Ne liittyvät yleensä kemiallisten ryhmien lisäämiseen ja proteiinien muodostavien aminohappojätteiden modifiointiin, mutta jotkut tärkeät modifikaatio aminohappojen O -peptidien merkkejä leikkauksista tai Klivajes proteolyyttinen.
Nämä modifikaatiot ovat mahdollisia tiettyjen erikoistuneiden soluentsyymien läsnäolon ja lisäksi pienten koostuvien energia -substraattien - ne eivät ole spontaaneja reaktioita - kuten esimerkiksi:
- ATP (adenosiini 5-fosfaatti)
- Asetyylikoentsyymi A (asetyyli Co-A)
- NAD+ (5'-nicinamidi 5'-difosfaatti adenosiini)
- S-adenosil Metionina (SAM)
- 5'-difosfaatti urasiili N-Asetyyliglukosamiini (UDP-GRCNAC)
- Urasiili 5'-glukoosi-difosfaatti (UDP-glukoosi)
- Muiden joukossa
Jotkut tärkeimmistä post -translaatiomuutoksista toimivat kytkimet (Suchit;.
Esimerkiksi monet solunsisäisiin organeliin kuuluvat proteiinit syntetisoidaan sytosolissa N-O-terminaalisilla päillä, jotka vastaavat Signalointisekvenssit, jotka tunnistavat muut proteiinit, jotka vastaavat niiden ohjaamisesta asianmukaiseen osastoon, ja matkalla nämä signaalit poistetaan yleensä proteiinirakenteesta.
Toinen erittäin silmiinpistävä esimerkki post -translaation jälkeisistä modifikaatioista, jotka liittyvät proteolyyttisen klivajen kanssa, on tiettyjen hormonien ja entsyymien kanssa, joilla on proteaasiaktiivisuutta, jotka syntetisoidaan inaktiivisina proteiineina, jotka tarvitsevat joidenkin niiden aminohappojen proteolyyttisen poistamisen aktiivisiksi muodoiksi.
Konjugoidut proteiinit
Vaikka niitä ei aina tunnusteta sellaisiksi, muut erittäin tärkeät translaation jälkeiset modifikaatiot ovat sellaisia, jotka sisältävät proteiinien muodostumisen, joiden rakenne koostuu yhdestä tai useammasta peptidiketjusta, jotka liittyvät ei -proteiiniyhdisteeseen joko kovalenttisten sidosten tai heikompien vuorovaikutusten ja väliaikainen.
Yleensä nämä proteiinit luokitellaan ei -proteiinifraktion identiteetin mukaan ja vaativat tällaisia osia toimintojensa suorittamiseksi.
Se voi palvella sinua: veriagarNämä fraktiot tai osat tunnetaan nimellä Proteesiryhmät Ja hyvä esimerkki näistä proteiineista on hemoglobiini, joka on kytketty hemo -ryhmään.
Endoplasminen retikulum toiminnassa
Monet translaation jälkeiset modifikaatiot alkavat karkean endoplasmisen retikulumin sisällä, jossa siihen liittyvät ribosomit kääntävät proteiineja, kun ne asetetaan tämän organelin kalvoon.
Endoplasmisessa retikulumissa monet proteiinit saavat lopullisen rakenteellisen konformaationsa: niiden signalointisekvenssit poistetaan, taitetaan oikeassa muodossa, muodostetaan disulfuriltoja, sokeriryhmiä lisätään jne.
Translaation jälkeiset muutokset
Eukaryoottisoluissa on kuvattu yli 500 tyyppiä erilaisia translaation modifikaatioita; Seuraava luettelo ryhmittelee joitain tutkituimmista:
-
Fosforylaatio
Yhden tai useamman fosfaattiryhmän siirtäminen korkean energian molekyyleistä, kuten ATP, kohti aminohappohydroksyyliryhmää, kuten seriini, treoniini ja tyrosiini; Sitä välittävät ryhmän entsyymit Miesten proteiinit (Nämä fosfaatit poistetaan entsyymeillä fosfataasit-A.
Se on tärkeää lukuisissa solutapahtumissa, kuten jako, signaalinsiirto, hiilihydraattien aineenvaihdunta, solujen kasvu ja solusyklin eteneminen muun muassa.
-
Sulfonaatio
Tämä on ryhmä -SO3H: n (sulfoninen) lisääminen yksinomaan tyrosiinin aminohapon jätteisiin ja on tyypillinen transmembraaliproteiineille tai erittyneille proteiineille. Sitä katalysoi tyrosil-sulfotransferaasientsyymit.
Se on tärkeä prosessi monien kalvoreseptoreiden toimintaan tietyntyyppisille solunsisäisille opasteille jne.
-
Disulfur -siltojen muodostuminen kysteiinien välillä
Tämä prosessi tapahtuu kysteiinitähteiden välillä ja on yksi tärkeimmistä jälkikäteen tapahtuvista translaatiomuutoksista rakenteellisesta näkökulmasta. Disulfidisiltot on perustettu organelleihin, kuten Golgi -kompleksi ja endoplasmisessa retikulumissa, joissa on hapettavia ympäristöjä.
Tämä translaation jälkeinen modifikaatio liittyy tietyn rakenteellisen kokoonpanon perustamiseen, joka on yleensä erittäin tärkeä lukuisten entsyymien aktiivisuudelle.
-
Metylaatio
Se koostuu metyyliryhmien lisäämisestä aminohappoihin, kuten lysiiniin, arginiiniin, histidiiniin, glutamiiniin ja asparagiiniin (N-metylaatioon), kuten aspartaatti ja glutamaatti (O-metylaatio) tai kysteiininä (S-metylaatio).
Se tapahtuu n-, o- tai s-metyylitransferaasina tunnetuiden entsyymien katalyyttisen vaikutuksen ansiosta. Proteiinimetylaatio on välttämätöntä geneettisen transkription säätelyssä histoniproteiinitasolla, mutta sillä on myös alhaisempi rooli signaalinsiirrossa.
-
Asetylointi
Se merkitsee asetyyliryhmien lisäämistä joidenkin proteiinien lysiinitähteisiin. Sitä katalysoi asetyylitransferaasientsyymit, ja sillä on myös erittäin tärkeitä toimintoja geneettisen ekspression säätelyn kannalta (histoniproteiinien tasolla, jotka sitoutuvat DNA: hon).
-
Hydroksylaatio
Sitä esiintyy yleensä proliini-, lysiini- ja asparagiinijätteissä, ja sitä katalysoituu raudasta riippuvilla hydroksylaasientsyymeillä. Tuloksena olevat aminohapot, hydroksiproli ja hydroksilisiini ovat erittäin tärkeitä joidenkin proteiinien (mukaan lukien kollageeni) ja joillekin antibiootteille ja sienilääkkeille (hydroksiasparagiini) kypsymiselle.
-
Glykosylaatio
Tämä modifikaatio on erittäin tärkeä prosessi eukaryoottisoluille. Se esiintyy pääasiassa seriini- ja parsagiinijätteissä, mutta se voi esiintyä myös hydroksiproliineissa tai hydroksilisiineissä.
Se voi palvella sinua: evoluutio: alkuperä, darwin, sosiaalinen, lineaarinen ja kulttuurinen evoluutioSe koostuu hiilihydraattimolekyylien lisäämisestä proteiinirakenteeseen, ja sitä katalysoi glykosyylitransferaasientsyymit ja esiintyy erityisesti erittymisproteiineissa ja solujen pinnassa olevissa.
-
Prenila
Se koostuu IsaPenilos (Lipid) -ryhmien siirrosta joihinkin proteiineihin. Vastuulliset entsyymit ovat spesifisiä siirtymiä jokaiselle ryhmälle.
Tämä prosessi on tärkeä joidenkin proteiinien ankkurointiin solukalvoihin, mutta tapahtuu myös signaalinsiirron aikana jne.
-
Ubikvitinaatio
Tämä on yhden tai useamman kopion kovalenttinen lisäys peptidistä, joka tunnetaan nimellä Ubikvitinit. Tämä lisäys brändi Proteiineille hajoamiseksi proteiinikompleksissa, joka tunnetaan nimellä 26S -proteosomi.
Se edustaa erittäin tehokasta solunsisäistä säätelyjärjestelmää ja vastaa proteiinien tuhoamisesta ATP-riippuvaisella reitillä ja osallistumalla kolme erilaista entsyymiä E1, E2 ja E3.
Esimerkit
Fosforylaatio ja glysilaatio ovat kaksi erittäin tärkeää translaation jälkeistä modifikaatiota solujen elämään. Ei vain siksi, että ne hallitsevat monia viestintään ja solusykliin liittyviä prosesseja, vaan myös siksi, että ne ovat hyvin yleisiä eukaryootien keskuudessa.
Esimerkiksi p53. Sen aktivointi riippuu erilaisten kinaasiproteiinien vaikutuksesta, jotka ovat vastuussa sen N-terminaalisen pään fosforylaatiosta.
Toisaalta eukaryoottisen solun pinta sisältää suuren määrän glykoproteiineja (translaation jälkeiset modifioidut proteiinit lisäämällä hiilihydraatteja).
Monilla näistä proteiineista on tärkeitä toimintoja immuunien tunnistamisessa, solujen migraatiossa, tunnistamisessa ja liitossa reseptoreihin, muun muassa.
Viitteet
- Alberts, b., Bray, D., Hopkin, k., Johnson, a. D -d., Lewis, J., Raff, m.,… & Walter, P. (2015). Välttämätön solubiologia. Garlantitiede.
- Cox, m. M., & Nelson, D. Lens. (2008). Lehninger -biokemian periaatteet. WHR FREEMAN.
- Garrett, r. H., & Grisham, c. M. (1999). Biokemia.
- Vihreä, k. D -d., & Garneau-Tesodikova, S. (2010). Proteiinien jälkeinen modifikaatio.
- Walsh, c. T., Garneau - -Sodikova, S., & Gatto Jr, G. J -. (2005). Translaation jälkeiset proteiinimodifikaatiot: proteomien monipuolistumisen kemia. Angewandte Chemie International Edition, 44 (45), 7342-7372.