Algebrallinen tasapainotusmenetelmä (esimerkeillä)

- 724
- 43
- Joshua Emmerich
Hän Algebrallinen tasapainomenetelmä Sitä käytetään kemiassa vastaamaan atomien lukumäärää kemiallisen reaktion molemmilla puolilla. Oikein kirjoitetussa kemiallisessa reaktiossa on oltava kaikkien vasemmalla puolella osallistuvien reagenssien kaavat ja tuotteet, myös niiden kaavoilla, oikealla puolella.
Kun sinulla on reaktio, reagenssien kaavoissa olevien atomien lukumäärä on yhtä suuri kuin vastaavien atomien määrät tuotteiden kaavoissa ei aina ole aina.
 Kuvio 1. Algebrallinen tasapainotusmenetelmä on yksinkertainen työkalu kemiallisten yhtälöiden tasapainottamiseen. Lähde: f. Zapata.
Kuvio 1. Algebrallinen tasapainotusmenetelmä on yksinkertainen työkalu kemiallisten yhtälöiden tasapainottamiseen. Lähde: f. Zapata. Taikina kuitenkin säilyy. Katsotaanpa esimerkiksi seuraava reaktio:
Kcl3 → Kcl + O2
Tällä yhtälöllä on yhdiste, nimeltään kaliumkloraatti, joka hajoaa kuumentamalla kaliumkloridi- ja kaasun happea. Mutta tarkkailemalla varovasti huomaamme, että kloraattimolekyylissä on 3 happiatomia, kun taas oikealla on vain yksi kaasun happimolekyyli, jossa on 2 atomia.
Sitten tehdään moninkertaistaa vasemman reagenssin numeerisella kertoimella, jotta kaikkien osallistuvien elementtien atomien lukumäärä on sama ennen ja jälkeen reaktion.
Mutta ... mikä on tämän kerroksen arvo?
[TOC]
Tapoja tasapainottaa yhtälöitä
Edellisessä yhtälössä on helppo määrittää asianmukaiset kertoimet tarkastuksella. Jos kerrotaan 2: lla vasemmalla, meillä on 2 atomia K, 2: sta ja 6: sta O: sta.
Siksi oikealla tavalla kerrotaan kaliumkloridi 2: lla ja O: lla2 Kolme: 3:
2 kclo3 → 2kcl + 3o2
Ja nyt voimme nähdä, että kirjanpito on oikein nuolen molemmilla puolilla ja reaktio oli tasapainossa. Huomaa, että muut numeeriset arvot voivat myös johtaa tasapainoiseen yhtälöön, esimerkiksi:
Voi palvella sinua: boorihappo: kemiallinen rakenne, ominaisuudet, valmistus, käyttö4 kclo3 → 4kcl + 6o2
Kuitenkin kokonaisia vähimmäislukuja, jotka ovat yhtä suuret kuin molemmin puolin atomien määrä.
Numeroita, jotka kertovat kutakin kaavaa kertoimet. On erittäin tärkeää huomata, että kertoimet voidaan määrittää tasapainoon, mutta alaindeksien on pysyttävä sellaisina kuin ne ilmestyvät jokaisessa kaavassa.
Kummankin yhdisteen kaavan keskelle ei voida asettaa kertoimia, koska se muuttaisi sitä.
Yksinkertaiset yhtälöt, kuten esimerkki, voidaan tasapainottaa tarkastuksella tai pisteellä. Niille, jotka ovat hiukan monimutkaisempia, on algebrallinen menetelmä, jossa on sarja yksinkertaisia vaiheita ja alkeellisia aritmeettisia operaatioita.
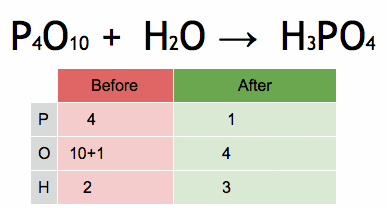 Kuva 2. Animaatio, joka osoittaa kemiallisen yhtälön tasapainottamisen fosforihapon saamiseksi. Lähde: Wikimedia Commons. Ephert/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)
Kuva 2. Animaatio, joka osoittaa kemiallisen yhtälön tasapainottamisen fosforihapon saamiseksi. Lähde: Wikimedia Commons. Ephert/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0) Vaiheet algebrallisesti tasapainottaa kemiallinen yhtälö
Vaihe 1
-Määritä jokaiselle molekyylille mielivaltainen kertoimet, symboloitu kirjaimella. Lyrics A, B, C, D .. ., tarpeen mukaan.
Tärkeä: Muista, että molekyyli käyttää vain kerrointa eikä sitä koskaan välitä sen keskelle, se on aina asetettu vasemmalle.
Vaihe 2
-Tee luettelo jokaisesta osallistuvasta elementistä.
Vaihe 3
-Aseta jokaiselle yhdisteelle määritetty kertoimet tai kertoimet vasemmalle ja sovi oikealle. Jos on alajaksoja, ne kertovat kertoimella atomien kokonaismäärän löytämiseksi.
Ja jos jokin elementti löytyy useammasta kuin yhdestä molekyylistä, lisätään kummallakin puolella olevat atomien määrät. Tällä tavalla osittaiset yhtälöt kunkin elementin.
Vaihe 4
-Yhdelle kertoimista osoitetaan numeerinen arvo. Yleensä tämä numeerinen arvo on 1 ja se on osoitettu kirjaimelle, joka näkyy useammin. Tämä saavuttaa yksinkertaisen yhtälön, joka toimii lähtökohtana löytääksesi muut kertoimet.
Voi palvella sinua: laimennuskerroinVaihe 5
-Määritä seuraavan kertoimen arvo yksinkertaisella aritmeettisella tavalla ja korvaa sen arvo toisessa yhtälössä, uuden nostamiseksi.
Vaihe 6
-Toista edellinen vaihe arvojen korvaamiseksi ja uuden yhtälön luomiseksi, kunnes löydät kaikki kertoimet.
Vaihe 7
-Korvaa siten määritetyt arvot. Jos nämä arvot ovat kokonaisia, on varmistettava, että yhtälö oli tasapainossa. Jos ne eivät olleet kokonaisia, se kerrotaan nimittäjien vähimmäismäärällä, ja tasapaino tarkistetaan.
Sitten visualisoimme näiden vaiheiden soveltamisen joidenkin esimerkkien resoluutioon.
Ratkaistu tasapainotusesimerkkejä
Esimerkki 1
Tasapaino seuraava reaktio tarvittaessa algebrallisen menetelmän avulla:
N2JOMPIKUMPI5 → N2JOMPIKUMPI4 + JOMPIKUMPI2
Ratkaisu
Huomaamme, että reaktio ei ole tasapainossa, koska vaikka molemmilla puolilla on 2 typpiatomia, hapen ollessa vasemmalla ja oikealla olevat määrät ovat erilaisia.
Sitten meidän on noudatettava edellisessä osassa kuvattuja vaiheita:
-Kirjoitamme yhtälön uudelleen ja kerrotaan jokainen molekyyli eri kertoimella. Pienet kirjaimet valitaan siten, että ne eivät ole sekoittuneet elementteihin:
A⋅n2JOMPIKUMPI5 → B⋅n2JOMPIKUMPI4 + C⋅o2
-Nyt luetellaan jokainen elementti ja sovitamme elementin määrät vasemmalle ja oikealle. Nämä ovat osittaiset yhtälöt jokaiselle elementille:
- A⋅n2 = B⋅n2
- A⋅O5 = B⋅o4 + C⋅o2
-Kerroin ja alaindeksi kertomalla typpiatomien lukumäärän. Yhtälöstä 1 saamme:
2a = 2b
-Yhtälöllä 2 on Viides happiatomit vasemmalle, ollessaan oikealla 4B ja 2 c-
5a = 4b + 2c
-Määritämme arvon 1 kerroin A, tällä tavalla:
A = 1
Tämä valinta on mielivaltainen, se voitaisiin myös valita ensin b = 1.
-Nämä arvot korvataan yhtälössä 2 C: n arvon määrittämiseksi:
Se voi palvella sinua: kuplioksidi (CuO)5 = 4 + 2c
2C = 5-4 = 1
C = ½
-Korvaamme alkuperäisen yhtälön kertoimet, 1 ei ole tarpeen kirjoittaa sitä nimenomaisesti:
N2JOMPIKUMPI5 → N2JOMPIKUMPI4 + ½ o2
-Koska on parempi, että kertoimet ovat kokonaisia, koko yhtälö kerrotaan nimittäjien vähimmäisyhteisellä monikerroksella, jotka ovat 2 ja 1:
m.c.m. (1,2) = 2
Sitten kertomalla vasen ja oikealla 2: lla, se saadaan:
2N2JOMPIKUMPI5 → 2n2JOMPIKUMPI4 + JOMPIKUMPI2
Ja lasketaan atomien lukumäärä molemmin puolin, tarkistaaksemme tasapaino:
- N vasemmalla: 4
- Tai vasemmalle: 10
- N oikealla: 4
- Tai oikeassa: 8 + 2 = 10
Esimerkki 2
Tasapainottaa seuraava kemiallinen reaktio:
Nahco3 → NA2Yhteistyö3 + H2Tai + Co2
Ratkaisu
Kerrota jokainen molekyyli eri kerroin:
A⋅ Nahco3 → B⋅NA2Yhteistyö3 + C⋅h2O + d⋅co2
Sitten ehdotamme kunkin elementin kirjanpitoa oikealle ja nuolen vasemmalle puolelle. Reaktiossa on yhteensä 4 elementtiä: natrium -na; Vety h; Autoauto ja happi tai kaikki on laskettava:
- A⋅NA = b⋅NA2
- a⋅h = c⋅h2
- A⋅c = b⋅c + d⋅c
- A⋅O3 = B⋅o3+C⋅o+d⋅o2
Kunkin saldon mukaan saadaan seuraavat yhtälöt:
1) a = 2b
2) a = 2c
3) a = b + d
4) A = 3B + C + 2D
Toistuvin kerroin on -lla, Siksi määritämme arvon 1:
A = 1
Niin:
1) a = 2b ⇒ b = ½
2) a = 2c ⇒ c = ½
3) a = b + d ⇒ d = a - b = 1 - ½ = ½
Korvaamme yhtälön kertoimet:
Nahco3 → ½. Naa2Yhteistyö3 + ½. H2O + ½.Yhteistyö2
Kerroin nuolen molemmilla puolilla 2: lla, koska se on ainoa läsnä oleva nimittäjä, joka eliminoi osan:
2NAHCO3 → NA2Yhteistyö3 + H2Tai + Co2
Laskemme vasemmalla olevien atomien lukumäärän: 2 atomia NA, H ja C ja 6 O: sta. Lukija voi varmistaa, että jokainen niistä on myös oikealla samoina määrinä.
Viitteet
- Atkins, p. Kemian periaatteet: löytöpolut. Pan -american lääketieteellinen toimitus. Kolmas painos.
- Briceño, J. USB -kemian opas. Toipunut: gecousb.com.mennä.
- Chang, R. 2013. Kemia. 11Va. Painos. MC Graw Hill Education.
- Ratkaisut. Algebrallinen tasapainotus. Haettu: Suelted -harjoitukset.yhteistyö.
- Simoza, l. Kemiallisten yhtälöiden tasapainotus. Toipunut: guao.org.
- « Kuolleet maksut ominaisuudet, laskelmat, esimerkit
- Inca -arkkitehtuuriominaisuudet ja erinomaiset rakenteet »

