Bariumnitraattikemiallinen rakenne, käyttö, ominaisuudet

- 632
- 126
- Gabriel Fahey
Hän bariumnitraatti Se on suola, joka koostuu bariumiatomista (BA) ja nitraatti -ionista (ei3-A. Se esitetään valkoisena kiteisenä kiinteänä aineena huoneenlämpötilassa ja on luonteeltaan erittäin harvinainen mineraali, joka tunnetaan nimellä nitrobarita. Sen ominaisuudet tekevät siitä myrkyllisen yhdisteen, jota on hoidettava huolellisesti.
Itse asiassa tällä yhdisteellä on useita käyttötarkoituksia sotilasteollisuudessa, koska se voidaan yhdistää muihin kemiallisiin aineisiin ja lisätä mm. Räjähtäviä ja syttyviä formulaatioita.
 Bariumnitraatin ulkonäkö. Lähde: W. OELEN/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Bariumnitraatin ulkonäkö. Lähde: W. OELEN/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) [TOC]
Kaava
Barium -nitraatilla, jota kutsutaan myös barium -dyitraatiksi, on kemiallinen kaava BA (ei3-A2, ja valmistetaan yleensä kahdella menetelmällä.
Ensimmäinen näistä sisältää pienten bariumkarbonaatin kappaleiden liukenemisen (Bacchus3) Keskipitkällä acidic -väliaineella (HNO3, Erittäin syövyttävä mineraalihappo), jolloin rautavaikutusten saostuminen ja sitten tämä seos suodatetaan, haihdutetaan ja kiteytetään.
Toinen menetelmä tehdään bariumkloridin yhdistelmällä (BACL2, Yksi bariumsuoloista, joilla on suurempi liukoisuus vedessä) esilämmitetyllä natriumnitraatin liuoksella. Tämä tuottaa reaktion, joka johtaa seoksen bariumnitraattikiteiden erottamiseen.
Bariumnitraatin kemiallinen rakenne
Tämä suola on kuutiomaisen kiteisen rakenteen tai vedettömän Octaedrosin ominaisuudet.
Sen kemiallinen rakenne on seuraava:
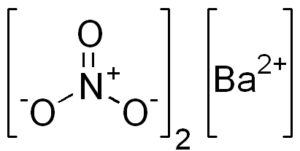
Dissosiaatio
Korkeissa lämpötiloissa (592 ºC) bariumnitraatti hajoaa muodostaen bariumoksidin (BAO), typpidioksidia (ei2) ja happi (tai2), Seuraavan kemiallisen reaktion mukaan:
Voi palvella sinua: Beryl -hydroksidi (BE (OH) 2)2BA (ei3-A2 + Lämpö → 2BAO + 4NO2 +JOMPIKUMPI2
Väliaineissa, joissa on korkea typpioksidin pitoisuudet (NO), bariumnitraatin hajoaminen tuottaa yhdisteen nimeltä bariumnitriitti (BA (no (no2-A2), Seuraavan yhtälön mukaan:
Kylpyhuone3-A2 + 2NO → BA (ei2-A2 + 22
Reaktiot liukoisen metallin tai rikkihapposulfaattien kanssa (H2Sw4) tuottaa bariumsulfaattia (baso4-A. Suurin osa liukenemattomista bariumsuoloista, kuten karbonaatti (Bacchus3), Oksalaatti (BAC2JOMPIKUMPI4) tai metallifosfaatti (BA3(PO4)2), saostetaan samanlaisilla kaksoishajoamisreaktioilla.
Bariumnitraatti käyttää
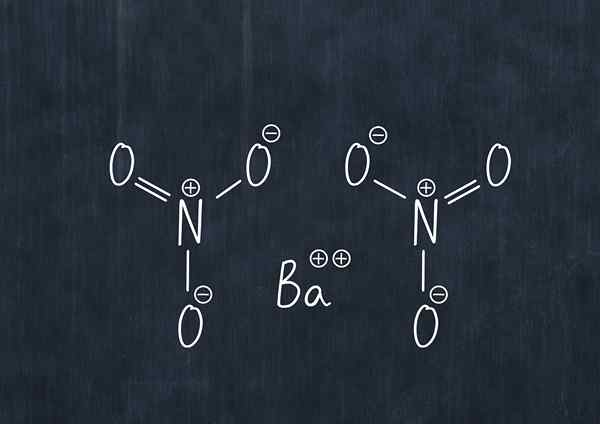 Bariumnitraatin kemiallinen kaava
Bariumnitraatin kemiallinen kaava Tämä pölyn aine on hapettava aine ja reagoi merkittävästi yleisten pelkistävien aineiden kanssa.
Kun tämä suola sekoitetaan muiden metallien, kuten alumiinin tai sinkin kanssa hienosti jaettujen muotojen tai seoksien, kuten alumiinin magn0esion kanssa, se kytkeytyy päälle ja hyödyntää vaikutusta. Tästä syystä bariumnitraattia pidetään erinomaisena osana sotilaallisia aseita ja räjähteitä.
Yhdessä trinitrotolueenin kanssa (kaupallisesti tunnetaan nimellä TNT tai C6H2(EI2-A3CH3) ja sideaine (säännöllisesti parafiinivaha), tämä suola muodostaa yhdisteen nimeltä Baratol, jolla on räjähteitä. Bariumnitraatin korkea tiheys aiheuttaa baratolin myös suuremman tiheyden, mikä tekee siitä tehokkaamman toiminnassaan.
Barium -nitraatti liittyy myös alumiinipölyyn, kaavaan, joka johtaa vilkkuvan ruuan muodostumiseen, jota käytetään pääasiassa ilotulitusvälineissä ja teatterin pyrotekniikassa.
Tämä välähdykset ovat nähneet myös soihduntuotannon (kuten lentokoneiden antimileiden mittaukset) ja tainnutetuissa kranaateissa. Lisäksi tämä aine on erittäin räjähtävä.
Se voi palvella sinua: natriumsyanidi (NACN): rakenne, ominaisuudet, riskit, käyttötarkoituksetTämä suola yhdistetään reagenssi -seokseen, jota kutsutaan termitiksi, jotta muodostuu tämän niin kutsutun terate -variaatio, joka tuottaa lyhyitä ja erittäin voimakkaita lämpötiloja pienillä alueilla lyhyen ajan.
Terate-Th3 on terate, joka sisältää 29 %: n koostumuksen bariumnitraattipainolla, joka auttaa lisäämään lämpövaikutusta, tuottavat liekkejä ja vähentävät merkittävästi termin sytytyslämpötilaa.
Therootsia käytetään yleensä syttyvän kranaatin tuotannossa ja niillä on tehtävä tuhota sotilaallinen säiliöpanssari ja rakenteet.
Lisäksi Barium -nitraatti oli yksi käytetyimmistä ainesosista tuotannossa syttymismaksuja, joita britit käyttivät toisen maailmansodan aikana sodan lentokoneissaan, jotka aseistettiin vihollisen lentokoneiden tuhoamiseen.
Lopuksi, tämä suola on käyttänyt bariumoksidin valmistusprosessissa, termionisen venttiiliteollisuudessa ja, kuten jo sanottiin, pyrotekniikan, etenkin vihreiden värien, luomisessa luomalla.
Fysikaaliset ja kemialliset ominaisuudet
 Bario Bai Nitrato (NO3) 2
Bario Bai Nitrato (NO3) 2 Suola esitetään valkoisena, hygroskooppisena ja wc -kiinteänä aineena, joka on vähän liukeneva veteen ja täysin liukenematon alkoholiin.
Sen moolimassa on 261 337 g/mol, tiheys 3,24 g/cm3 ja fuusiopiste 592 ºC. Saavuttuaan kiehumispisteensä se hajoaa, kuten yllä on sanottu. Huoneen lämpötilassa sen veden liukoisuus on 10,5 g/100 ml.
Sitä pidetään vakaana, mutta se on vahva hapettava aine ja sen on oltava poissa palavista materiaaleista tulipalon välttämiseksi. Sillä on vesiherkkyys, eikä sitä pidä sekoittaa happojen tai vedettömien kanssa.
Voi palvella sinua: Adsorptio -isotermit: konsepti, tyypit, esimerkitKorkeissa pitoisuuksissa (esimerkiksi säiliöt) on eristettävä aineista, jotka voivat saada sen reagoimaan, koska se voi hyödyntää väkivaltaisesti.
Kuten mikä tahansa muu bariumyhdiste, se on myrkyllinen aine eläimille ja ihmisille.
Sitä ei pidä hengittää tai kuluttaa, koska myrkytyksen oireet (etenkin kasvojen lihaksen kovettuminen), oksentelu, ripuli, vatsakipu, lihaksen vapinaa, ahdistusta, heikkoutta, hengitysvaikeuksia, sydämen epäsäännöllisyyttä ja kouristuksia ja kouristuksia.
Kuolema voi tapahtua tämän aineen myrkytyksen jälkeen, muutama tunti tai muutama päivä esityksen jälkeen.
Bariumnitraatin hengittäminen aiheuttaa ärsytystä hengityselinten limakalvossa ja molemmissa myrkytysmuodoissa on valmistettava sulfaattisuolojen liuoksia, jotta voidaan soveltaa ensiapua kärsivälle.
Viljojen tapauksessa se on eristettävä palavista aineista ja materiaaleista, ja tulen tapauksessa sinun ei tule koskaan joutua kosketuksiin kuivien kemikaalien tai vaahtojen kanssa. Alue on tulvittava vedellä, jos tuli on suurempi.
Viitteet
- Mabus. (S.F.-A. Tiede. Saatu tiedekunnasta.org
- Yhdysvaltain infpuniaripommi Th3-M50A3. (S.F.-A. Saatu ampuma -alueista.com
- Cameo -kemikaalit. (S.F.-A. Saatu kameramerkistä.NOAA.Hallitus
- Chemspider. (S.F.-A. Saatu Chemspideriltä.com

