Kuparinitraatti (II)
- 4212
- 1062
- Mr. Clifford Kshlerin
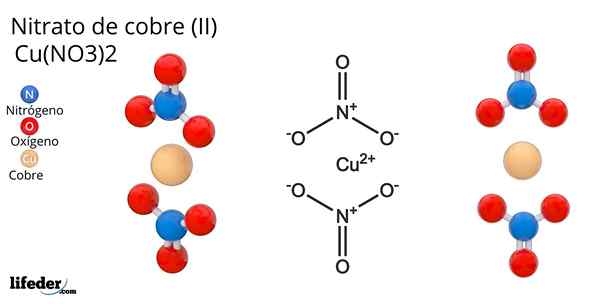
 Kuparinitraatin kaava ja rakenne (II)
Kuparinitraatin kaava ja rakenne (II) Hän kuparinitraatti (Ii) tai kupli -nitraatti, jonka kemiallinen kaava on Cu (ei3-A2, Se on loistava epäorgaaninen suola ja houkuttelevat sinivihreät värit. Se syntetisoidaan teollisessa mittakaavassa kuparimineraalien hajoamisesta, mukaan lukien Gerhardita ja Rouaita mineraalit.
Muut toteutettavissa olevat menetelmät raaka -aineen ja haluttujen suolan määrien suhteen koostuvat suorista reaktioista metallikuparin ja sen johdettujen yhdisteiden kanssa. Kun kupari on kosketuksessa typpihapon konsentroituneen liuoksen kanssa (HNO3), Redox -reaktio tapahtuu.
Tässä reaktiossa Copper hapettaa ja typpi vähenee seuraavan kemiallisen yhtälön mukaan:
Cu (s) + 4HNO3(conc) => cu (ei3-A2(AC) + 2H2Tai (l) + 2no2(g)
Typpidioksidi (ei2) on ruskea ja haitallinen kaasu; Tuloksena oleva vesiliuos on sinertävä. Kupari voi muodostaa kupion ionin (Cu+), Kupli -ioni (Cu2+) tai vähiten yleinen ion Cu3+; Kukio -ionita ei kuitenkaan suosia vesipitoisissa väliaineissa monien elektronisten, energia- ja geometristen tekijöiden avulla.
CU: n vakiovähennyspotentiaali+ (0,52 V) on suurempi kuin Cu2+ (0,34 V), mikä tarkoittaa, että Cu+ Se on epävakaampi ja pyrkii voittamaan elektronin tulla Cu (s). Tämä sähkökemian mitta selittää miksi ei ole CUNO: ta3 reaktion tuotteena tai ainakin vedessä.
[TOC]
Kuparinitraatin ominaisuudet
 Kuparinitraatin ulkonäkö (ii) triohydraatti
Kuparinitraatin ulkonäkö (ii) triohydraatti Kuparinitraatti on anhydridi (kuiva) tai hydratoitu erilaisilla vedellä. Anhydridi on sininen neste, mutta koordinoinnin jälkeen vesimolekyylien kanssa - kykenevä muodostamaan vety sillat - kiteyttää kuinka Cu (ei3-A2· 3H2O o cu (ei3-A2· 6H2JOMPIKUMPI. Nämä ovat markkinoiden kolme eniten saatavilla olevaa suolamuotoa.
Se voi palvella sinua: Helmholtz Free Energy: Yksiköt, miten se lasketaan, ratkaistu harjoituksetKuivan suolan molekyylipaino on 187,6 g/mol, lisäämällä tähän arvoon 18 g/mol jokaiselle suolaan sisällytettyyn vesimolekyyliin. Sen tiheys on yhtä suuri kuin 3,05 g/ml, ja se pienenee jokaisella sisäänrakennetulla vesimolekyylillä: 2,32 g/ml kolmi-hydratoidulle suolalle ja 2,07 g/ml heksa-hydratoituneelle suolalle. Sillä ei ole kiehumispistettä, mutta Sublima.
Kolme kuparinitraatin muotoa ovat voimakkaasti liukoisia veteen, ammoniakkiin, dioksaaniin ja etanoliin. Sen sulamispisteet laskeutuvat, kun toinen molekyyli lisätään kuparin ulkoiseen koordinointipiloon; Fuusiota seuraa kuparinitraatin lämpöhajoaminen, mikä tuottaa ei -haitallisia kaasuja2-
2 Cu (ei3-A2(s) => 2 cuo (s) + 4 ei2(g)+ tai2(g)
Yllä oleva kemiallinen yhtälö on anhydridisuola; Hydratoituneille suoloille vesihöyry esiintyy myös yhtälön oikealla puolella.
Elektroninen kokoonpano
Elektroninen kokoonpano ion -cu: lle2+ Se on [AR] 3D9, Esitetään paramagnetismi (elektroni 3D -kiertoradalla9 on kadonnut).
Koska kupari on jaksollisen taulukon neljännen jakson siirtymämetalli ja menettänyt kaksi sen Valencia -elektronia HNO: n toimintaa kohti3, Siinä on edelleen 4S- ja 4p -orbitaalit käytettävissä kovalenttisten sidosten muodostamiseksi. Vielä enemmän, Cu2+ Voit käyttää kahta sen ulointa 4D -orbitaalia voidaksesi koordinoida jopa kuusi molekyyliä.
Anionit Ei3- Ne ovat tasaisia ja CU: lle2+ Voit koordinoida heidän kanssaan on oltava SP -hybridisaatio3d -d2 Tämän avulla voit omaksua oktaedrisen geometrian; Tämä estää anioneja ei3- olla "osuma" heidän joukossaan.
Se voi palvella sinua: tiivistetty kaava: Mikä on ja esimerkkejä (metaani, etaani, glukoosi ...)Tämän saavutetaan CU2+, sijoittamalla ne neliötasoon itsensä ympärille. Tuloksena oleva Cu -atomin kokoonpano suolassa on: [AR] 3D94S24P6.
Kemiallinen rakenne
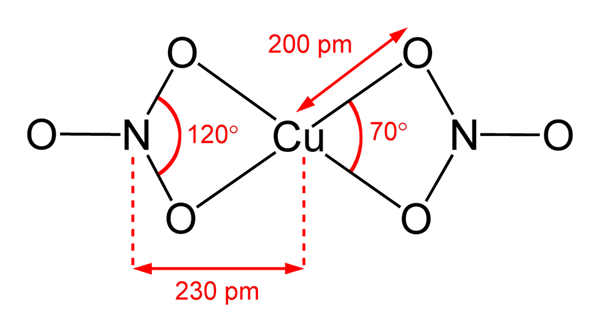 Kuparinitraattirakenne (II)
Kuparinitraattirakenne (II) Ylemmässä kuvassa on edustettuna Cu: n eristetty molekyyli (ei3-A2 kaasufaasissa. Nitraatin anionihapiatomit koordinoivat suoraan kuparikeskuksen (sisäinen koordinaatioalue) kanssa, muodostaen neljä Cu-O-sidosta.
Siinä on neliötaso molekyyligeometria. Punaiset pallot piirtävät tason kärkipisteissä ja kuparin pallo keskellä. Kaasumaisen vaiheen vuorovaikutukset ovat erittäin heikkoja johtuen elektrostaattisista torjumisesta ryhmien välillä, jotka eivät3-.
Kiinteässä vaiheessa kuparikeskukset muodostavat kuitenkin metallilinkit -cu-cu-, luomalla polymeerisiä kupariketjuja.
Vesimolekyylit voivat muodostaa vety silloja ryhmien kanssa3-, Ja nämä tarjoavat vety silloja muille vesimolekyyleille ja niin edelleen, kunnes vesipapa on Cu (ei3-A2.
Tällä alueella siinä voi olla 1–6 ulkoista naapuria; Siksi suola on helposti hydratoitunut hydratoitujen kolmi- ja heksa -suolojen tuottamiseksi.
Suola muodostuu ion cu: sta2+ ja kaksi ionia ei3-, ionisten yhdisteiden ominaisen kiteisyyden myöntäminen (ortorromiset anhydridisuolalle, rhomboédica hydratoituneille suoloille). Linkit ovat kuitenkin suurempia kovalenttisia merkkejä.
Käyttää/sovelluksia
Kuparinitraatin kiehtoville väreille tämä suola löytää käyttöä lisäaineena keramiikassa, metallipinnoilla, joissain ilotulitusvälineissä ja myös tekstiiliteollisuudessa mordanttina.
Voi palvella sinua: entalpiaSe on hyvä ionisen lähde monille reaktioille, etenkin sellaisille, joissa se katalysoi orgaanisia reaktioita. Se löytää myös samanlaisia käyttötarkoituksia muille nitraateille, joko sienitarnat, rikkakasvien torjunta -aineen tai puisen säilöntäaineena.
Toinen sen tärkeimmistä ja uusimmista käytöstä on CuO -katalyyttien synteesissä tai valoherkän ominaisuuden materiaaleissa.
Sitä käytetään myös klassisena reagenssina laboratorioiden opettamisessa reaktioiden osoittamiseksi voltaatisolujen sisällä.
Riskejä
- Se on voimakkaasti hapettava aine, haitallinen merille, ärsyttävälle, myrkylliselle ja syövyttävälle ekosysteemille. On tärkeää välttää kaikki fyysiset kosketukset suoraan reagenssin kanssa.
- Se ei ole syttyvä.
- Se hajoaa korkeissa lämpötiloissa, jotka vapauttavat ärsyttäviä kaasuja2.
- Ihmisen organismissa se voi aiheuttaa kroonisia vaurioita keskus- ja verisuoni- ja hermostojärjestelmille.
- Voi aiheuttaa ärsytyksiä maha -suolikanavassa.
- Nitraatti, kehossa siitä tulee nitriitti. Nitriitti herättää tuhoja veressä ja sydän- ja verisuonijärjestelmässä.
Viitteet
- Päivä, r., & Underwood, a. Kvantitatiivinen analyyttinen kemia (Viides ed.-A. Pearson Prentice Hall, P-810.
- Mel -tiede. (2015-2017). Mel -tiede. Toipunut Mel Science: Melscience.com
- Researchgate GmbH. (2008-2018). Tutkimussarja. ResearchGatesta toipunut: ResearchGate.netto
- Tiedelaboratorio. Tiedelaboratorio. Toipunut Science Lab: sciencelab.com
- Whitten, Davis, Peck ja Stanley. (2008). Kemia (Kahdeksas ed.-A. P-321. Cengage -oppiminen.
- Wikipedia. Wikipedia. Wikipedia toipui: vuonna.Wikipedia.org

