Hopea -nitraatti (AGNO3) rakenne, ominaisuudet, käyttö, myrkyllisyys

- 2096
- 432
- Edgar VonRueden
Hän hopeanitraatti Se on epäorgaaninen suola, jonka kemiallinen kaava on Agno3. Kaikista hopeasuoloista se on taloudellisin ja se, joka aiheuttaa suhteellisen vakauden auringonvaloa vastaan, joten on taipumus hajottaa vähemmän. Se on liukoinen ja ennakkoluulo hopealähde jokaisessa opetus- tai tutkimuslaboratoriossa.
Opetuksessa vesipitoisia hopea -nitraattiliuoksia käytetään hopeakloridin saostumisreaktioiden opettamiseen. Samoin nämä liuokset asetetaan kosketukseen metallikuparin kanssa rédox -reaktion tapahtumiseksi, jossa metallihopea saostuu kuparinitraatin muodostetun liukenemisen keskellä (ei (ei3-A2.
 Hopea -nitraattinäytin säiliö. Lähde: W. OELEN/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Hopea -nitraattinäytin säiliö. Lähde: W. OELEN/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Yläkuvassa esitetään pullo hopea -nitraatilla. Se voidaan pitää alttiina valolle ilman kiteidensä pimeää, hopeaoksidin ulkonäön tuote.
Alkeemisten tapojen ja metallihopean antibakteeristen ominaisuuksien jälkeen hopea -nitraattia on käytetty haavojen desinfiointiin ja kauterisointiin. Tätä tarkoitusta varten käytetään kuitenkin hyvin laimennettuja vesiliuoksia tai sen kiinteää kiinteää kaliumnitraatin kanssa levitettyä puulangan kärjessä.
[TOC]
Hopea -nitraattirakenne
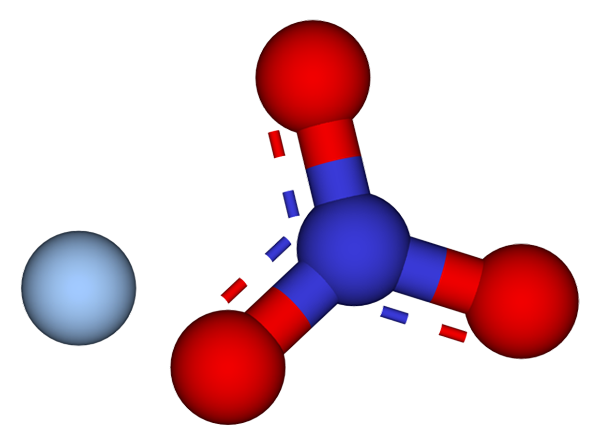 Ionit, jotka muodostavat hopea -nitraattikiteitä. Lähde: CCOIL/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)
Ionit, jotka muodostavat hopea -nitraattikiteitä. Lähde: CCOIL/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Yläkuvassa ag -ionit esitetään+ ja ei3- hopea -nitraattia, joita edustaa malli palloista ja palkista. Agno -kaava3 osoittaa tämän suolan stökiometrisen osuuden: jokaiselle kationille AG+ Ei ole anionia3- vuorovaikutuksessa hänen kanssaan sähköstaattisesti.
Se voi palvella sinua: rikki: historia, ominaisuudet, rakenne, hankkiminen, käyttöAnionin ei3- (Punaisen ja sinertävän pallo) on trigonaalinen tasainen geometria, negatiivisen kuormituksen ollessa kolmen happiatomin välillä. Siksi kahden ionin välinen sähköstaattinen vuorovaikutus tapahtuu erityisesti kationin AG: n välillä+ ja anionin happiatomi ei3- (AG+-TAI EI2--A.
Tällä tavalla jokainen AG+ päätyy koordinointiin tai ympäröimään kolmea ei3- samassa tasossa tai kristallografisessa kerroksessa. Näiden tasojen ryhmittely lopulta määrittelee kide, jonka rakenne on ortorrominen.
Valmistautuminen
Hopea -nitraatti valmistetaan hyökkäämällä kiillotettuun metallihopeakappaleeseen typpihapolla, olipa sitten kylmä tai kuuma tiivistetty:
3 Ag + 4 hno3 (laimennettu) → 3 Agno3 + 2 h2O +ei
Ag + 2 hno3 (keskittynyt) → Agno3 + H2O +ei2
Huomaa kaasujen muodostuminen ei2, jotka ovat myrkyllisiä ja pakottavat tätä reaktiota ei suoriteta uuttokellon ulkopuolella.
Fysikaaliset ja kemialliset ominaisuudet
Fyysinen ulkonäkö
Väritön kiteinen kiinteä, wc, mutta erittäin katkera maku.
Moolimassa
169 872 g/mol
Sulamispiste
209,7 ºC
Kiehumispiste
440 ºC. Tässä lämpötilassa kärsii kuitenkin lämpöhajoamisesta, jossa metallihopeaa esiintyy:
2 Agno3(l) → 2 ag (s) + o2 (g) + 2 ei2 (g)
Agno -höyryjä ei ole3, Ainakin ei maanpäällisissä olosuhteissa.
Liukoisuus
Agno3 Se on uskomattoman liukoinen veden säästö, jonka liukoisuus on 256 g/ 100 ml 25 ° C: ssa. Se on myös liukoinen muihin polaarisiin liuottimiin, kuten ammoniakki, etikkahappo, asetoni, eetteri ja glyseroli.
Tiheys
4,35 g/cm3 24 ° C: ssa (ympäristön lämpötila)
Voi palvella sinua: tislattua vettä3,97 g/cm3 210 ºC: lla (vain sulamispisteessä)
Vakaus
Agno3 Se on vakaa aine aina, kun se on varastoitu oikein. Se ei tule tulehtumaan mihin tahansa lämpötilaan, vaikka se voidaan hajottaa vapauttamalla typpioksidit myrkylliset höyryt.
Toisaalta, vaikka hopea -nitraatti ei ole syttyvää, se on voimakas hapettumisaine, joka otetaan yhteyttä orgaaniseen aineeseen ja lämmönlähteeseen, kykenee käynnistämään eksotermisen ja räjähtävän reaktion.
Tämän lisäksi tätä suolaa ei pidä altistaa liikaa aikaa auringonvaloon, koska niiden kiteet tummuvat hopeaoksidin muodostumisen vuoksi.
Hopea -nitraatti käyttää
Saostava ja analyyttinen aine
Edellisessä osassa mainittiin Agnon uskomaton liukoisuus3 Vedessä. Tämä tarkoittaa, että ag -ionit+ Ne liukenevat ilman mitään ongelmia ja ovat käytettävissä vuorovaikutuksessa minkä tahansa vesipitoisen keski -ionin, kuten halogenidianionien kanssa (x = f-, Cl-, Br- ja minä--A.
Hopea kuin Ag+, Ja HNO: n lisäämisen jälkeen3 laimennettu, saostuu läsnä olevat fluoridit, kloridit, bromidit ja jodidit, jotka koostuvat valkoisista tai kellertävistä kiinteistä aineista:
Ag+(AC) +x-(AC) → Agx (s)
Tämä tekniikka on hyvin toistuva halogeenien saamiseksi, ja sitä käytetään myös lukuisissa kvantitatiivisissa analyyttisissä menetelmissä.
Tollens -reagenssi
Agno3 Sillä on myös analyyttinen rooli orgaanisessa kemiassa, koska se on tärkein reagenssi, ammoniakin vieressä, Toillens -reagenssin valmistukseen. Tätä reagenssia käytetään laadullisissa kokeissa, jotka sallivat aldehydien ja ketonien läsnäolon ongelmanäytteessä.
Synteesi
Agno3 Se on erinomainen liukoinen hopea -ionilähde. Tämä tekee suhteellisen ja alhaisten kustannusten lisäksi siitä pyydetyn reagenssin lukemattomille orgaanisille ja epäorgaanisille synteesille.
Se voi palvella sinua: Gibbs Free Energy: Yksiköt, miten se lasketaan, ratkaistu harjoituksetReaktiosta riippumatta, jos tarvitset ag -ioneja+, Joten on melko todennäköistä, että kemikaalit turvautuvat Agnoon3.
Lääketieteellinen
Agno3 Hänellä oli paljon suosiota lääketieteessä ennen nykyaikaisten antibioottien ulkonäköä. Nykyään sitä käytetään edelleen tietyissä tapauksissa, koska sillä on Caulster- ja antibakteeriset ominaisuudet.
Yleensä se sekoitetaan knon kanssa3 Puisten sauvojen kärjessä niin, että se on varattu yksinomaan ajankohtaisiin käyttötarkoituksiin. Tässä mielessä se on palvellut syylien, haavojen, tartunnan saaneiden kynsien, nenän suun haavaumien ja verenvuotojen hoidossa. Agno -seos3-Kno3 Cauteriza iho tuhoaa vaurioituneet kudokset ja bakteerit.
Agnon bakteerisidinen vaikutus3 Sitä on käytetty myös vedenpuhdistuksessa.
Toksisuus ja sivuvaikutukset
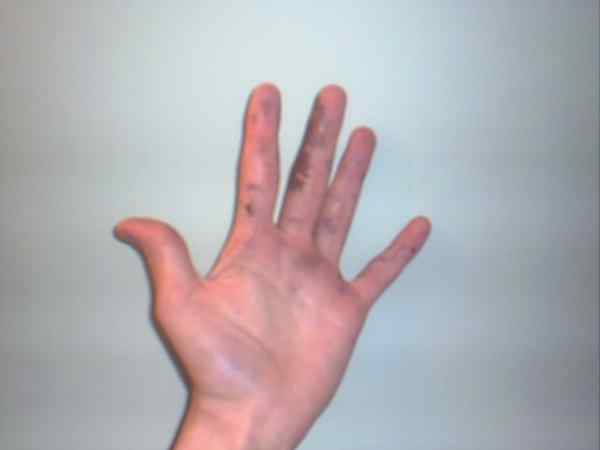 Hopea -nitraatti voi aiheuttaa palovammoja, jotka esitetään heidän purppura- tai tummillaan. Lähde: Badenin Jane englanniksi Wikipedia / julkinen verkkotunnus
Hopea -nitraatti voi aiheuttaa palovammoja, jotka esitetään heidän purppura- tai tummillaan. Lähde: Badenin Jane englanniksi Wikipedia / julkinen verkkotunnus Vaikka hopea -nitraatti on vakaa palkka eikä se edusta liikaa riskejä, se on erittäin kaustinen kiinteä aine, jonka nauttiminen voi aiheuttaa vakavia maha -suolikanavan vaurioita.
Siksi suositellaan sen käsineitä sen manipulointia. Se voi polttaa ihon, ja joissain tapauksissa tummentaa sitä, kunnes se muuttuu argiriaksi kutsutun purppuran, tilan tai sairauden.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Hopeanitraatti. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2020). Hopeanitraatti. Pubchem -tietokanta., CID = 24470. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Elsevier B.V. (2020). Hopeanitraatti. Tiede. Haettu: ScienEdirect.com
- Iowan yliopisto. (2020). Hopea -nitraatin käyttö ja toksisuus. Toipunut: Lääketiede.Uiowa.Edu
- P.F. Lindley & P. Puuleikkaus. (1966). Yksi X-Hopea -nitraatin Ray -tutkimus: ainutlaatuinen metallitraattirakenne. Chemical Society -lehti A: epäorgaaninen, fysikaalinen, teoreettinen.
- Lucy Bell Young. (2020). Mitkä ovat hopea -nitraatin lääketieteelliset käyttötarkoitukset. Reagenssikemikaalit. Talteenotettu: kemikaalit.yhteistyö.Yhdistynyt kuningaskunta
- « Piperidiinirakenne, synteesi, johdannaiset, reaktiot
- C ++ Historia, ominaisuudet, tietotyypit, esimerkit »

