Kaliumnitraatti (Kno3)
- 1020
- 115
- Louis Moen
Mikä on kaliumnitraatti?
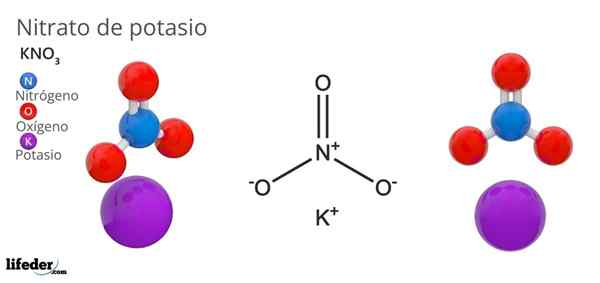
Hän kaliuminitraatti Se on kolmen suolainen suola, joka koostuu kaliumista, alkalista metallista ja nitraattisista oksoanioista. Sen kemiallinen kaava on kno3, Mikä tarkoittaa, että jokaiselle K -ionille+, Ionia ei ole3-- vuorovaikutuksessa tämän kanssa. Siksi se on ionisuola ja muodostaa yhden alkalista nitraateista (Lino3, Vanhempi veli3, Rbno3…).
Kno3 Se on vahva hapettava aine nitraatti -anionin läsnäolon vuoksi. Eli se toimii kiinteiden nitraatti -ionien varana, toisin kuin muut erittäin liukoiset suolat vedessä tai erittäin hygroskooppinen. Monet tämän yhdisteen ominaisuudet ja käytöt johtuvat nitraatti -anionista, eikä kaliumkationista.
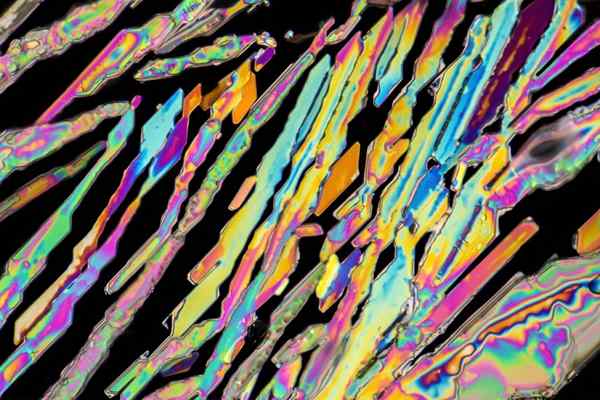 Kaliumnitraattikiteitä
Kaliumnitraattikiteitä Yläkuvassa kuvataan joitain Knon kiteitä3 neulamuotoilla. Knon luonnollinen lähde3 on Saltpeter, tunnetaan nimellä Salpietari jompikumpi Ilmapallo, englanniksi. Tätä elementtiä tunnetaan myös nimellä Potassa -nitraatti tai nitro -mineraali.
Se sijaitsee kuivilla tai autiomaisilla alueilla, samoin kuin kavernoosien seinien poistot. Toinen tärkeä Knon lähde3 Kuivien ympäristöjen asuttavien eläinten guano, eläinten ulosteet.
Kaliumnitraatin kemiallinen rakenne
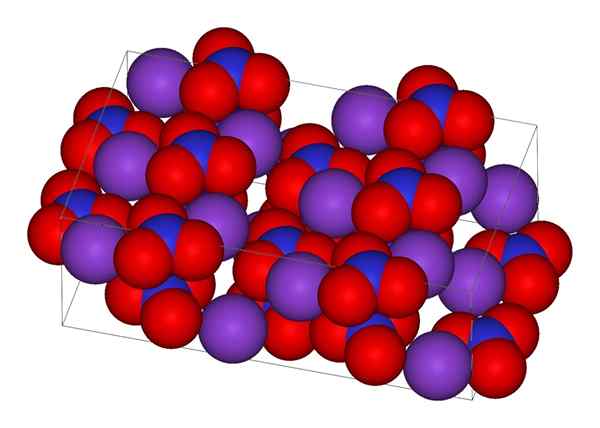 Kaliumnitraatin kiteinen rakenne
Kaliumnitraatin kiteinen rakenne Yläkuvassa Knon kiteinen rakenne on esitetty3. Violetti pallot vastaavat k -ioneja+, kun taas punaiset ja siniset ovat vastaavasti happi- ja typpiatomeja. Kiteinen rakenne on ortorrominen huoneenlämpötilassa.
Nionin geometria ei3- Se on trigonaalista tasoa, jossa on happiatomeja kolmion kärkipisteissä ja typpiatomi sen keskellä. Se esittelee positiivisen muodollisen kuorman typpiatomiin ja kaksi negatiivista muodollista kuormaa kahdessa happiatomissa (1-2 = (-1)).
Voi palvella sinua: yksinkertainen mikroskooppiNämä kaksi negatiivista maksua ei3- Ne siirtyvät kolmen happiatomin välillä, ylläpitäen aina positiivista kuormaa typessä. Edellä esitetyn seurauksena K -ionit-+ Niistä kiteistä, joita he välttävät olemasta juuri anionien typen ylä- tai alapuolella3-.
Itse asiassa kuva osoittaa kuinka k -ionit+ Niitä ympäröivät happiatomit, punaiset pallot. Yhteenvetona voidaan todeta, että nämä vuorovaikutukset ovat vastuussa kiteisistä järjestelyistä.
Muut kiteiset vaiheet
Muuttujat, kuten paine ja lämpötila, voivat muokata näitä järjestelyjä ja aiheuttaa kno: n erilaisia rakenteellisia vaiheita3 (Vaiheet I, II ja III). Esimerkiksi vaihe II on kuva, kun taas vaihe I (trigonaalisen kiteisen rakenteen kanssa) muodostuu, kun kiteitä kuumennetaan arvoon 129 ºC.
Vaihe III on siirtymävaiheinen kiinteä aine, joka saadaan vaiheen I jäähdytyksestä, ja jotkut tutkimukset ovat osoittaneet, että sillä on joitain tärkeitä fysikaalisia ominaisuuksia, kuten ferroelektiivisyys. Tässä vaiheessa kide muodostaa kaliumkerroksia ja nitraatteja, jotka ovat mahdollisesti herkkiä ionien välisten sähköstaattisten torjunnoille.
Vaiheen III kerroksissa anionit3- He menettävät vähän tasomaisuudestaan (kolmio käyrät hieman) tämän järjestelyn sallimiseksi, josta ennen mekaanista häiriötä tulee vaiheen II rakenteeksi.
Kaliumnitraatti käyttää/sovelluksia
Suola on erittäin tärkeä, koska sitä käytetään lukuisissa ihmisen toiminnoissa, jotka ilmenevät teollisuudessa, maataloudessa, ruoassa jne. Nämä käytöt sisältävät seuraavat:
- Ruoan säilyttäminen, erityisesti liha. Huolimatta epäilyksestä, että se puuttuu nitrosamiinin (karsinogeenisen aineen) muodostumiseen, käytetään edelleen charcuteriessa.
- Lannoite, koska kaliumnitraatti tarjoaa kaksi kolmesta kasvista makroravinteista: typpi ja kalium. Yhdessä fosforin kanssa tämä elementti on välttämätön kasvien kehittämiselle. Eli se on tärkeä ja hallittavissa oleva näiden ravintoaineiden varanto.
- Kiihdyttää palamista, kykyä tuottaa räjähdyksiä, jos palava materiaali on laaja tai jos se on hienosti jaettu (suurempi pinta -ala, suurempi reaktiivisuus). Lisäksi se on yksi ruutin pääkomponenteista.
- Helpottaa hittuneiden puiden kosketusten poistamista. Nitraatti toimittaa sienten välttämättömän typen kannan puun tuhoamiseksi.
- Se puuttuu hammasherkkyyden vähentymiseen sisällyttämisen kautta hammaslääketieteen, mikä lisää kylmän, lämmön, hapon, makeisten tai kosketusten tuottaman hampaan tuskallisia tuntemuksia.
- Puuttuu hypotensorina verenpaineen säätelyssä ihmisillä. Tämä vaikutus annetaan tai liittyy siihen natriumin erittymisen muutoksen kanssa. Hoidossa suositeltu annos on 40-80 mekv/päivä kaliumia. Tältä osin huomautetaan, että kaliumnitraatilla olisi diureettinen vaikutus.
Synteesi
Suurin osa nitraatista tuotetaan Chilen aavikkojen kaivoksissa. Se voidaan syntetisoida useilla reaktioilla:
Nh4EI3 (AC) +KOH (AC) => NH3 (Ac) +kno3 (AC)+H2Tai (l)
Kaliumnitraatti myös neutraloi typpihappoa kaliumhydroksidilla erittäin eksotermisessä reaktiossa.
KOH (AC) +HNO3(conc) => kno3 (AC) +H2Tai (l)
Teollisessa mittakaavassa kaliumnitraatti tuotetaan kaksinkertaisella siirtymäreaktiolla.
Vanhempi veli3 (ac) +kcl (ac) => nacl (ac) +kno3 (AC)
KCL: n päälähde on Silvina Mineralista, eikä muista mineraaleista, kuten karnaliitista tai kaaiitista, jotka koostuvat myös ionisesta magnesiumista.
Fysikaaliset ja kemialliset ominaisuudet
Kaliumnitraatti kiinteässä tilassa esitetään valkoisena tai ortoromisten rakenteen kiteiden muodossa ympäristön lämpötilassa ja trigonaalinen lämpötilassa 129 ºC. Sen molekyylipaino on 101 1032 g/mol, se on wc ja siinä on suolaliuoksen hehtaarin maku.
Se on hyvin liukoinen yhdiste vedessä (316-320 g/litraa vettä, 20 ° C: ssa) sen ionisen luonteen ja vesimolekyylien helppouden vuoksi K-ionin K: n ratkaisemiseksi+.
Sen tiheys on 2,1 g/cm3 25 ºC: lla. Tämä tarkoittaa, että se on noin kaksi kertaa tiheä kuin vesi.
Sen sulamispisteet (334 ºC) ja kiehuminen (400 ºC) osoittavat ionisidokset K: n välillä+ ja ei3-. Ne ovat kuitenkin alhaisia verrattuna muihin suoloihin, koska kiteinen retikulaarinen energia on alhaisempi yksiarvoisissa ioneissa (ts. Kuormilla ± 1), eikä niillä myöskään ole kovin samankaltaisia kokoja.
Voi palvella sinua: pH -indikaattoritSe hajoaa lämpötilassa lähellä kiehumispistettä (400 ° C) kaliumin ja molekyylin hapen tuottamiseksi:
Kno3(S) => kno2(s) + tai2(g)
Viitteet
- Pubchem. (2018). Kaliuminitraatti. PubChemistä toipunut.NCBI.Nlm.Nik.Hallitus
- Kristalli. (2009). Vaiheen III kaliumnitraatin, kno3. B65, 659-663.
- Marni Wolfe. (3. lokakuuta 2017). Kaliumnitraattiriskit. Livestrong toipunut.com
- Ametistigalleriat, inc. (1995-2014). Mineraali -niter. Galleriat toipuivat.com