Nitraattien ominaisuudet, rakenne, nimikkeistö, koulutus
- 1201
- 232
- Ronald Reilly
Se Nitraatit Ne ovat kaikki ne yhdisteet, jotka sisältävät anionia3-, Epäorgaanisten suolojen tai nitro -ryhmän suhteen -ono2, Orgaanisten johdannaisten tapauksessa. Epäorgaanisissa, kaikki nitraatit ovat metallisuoloja tai ammonium -ionia, joissa sähköstaattiset vuorovaikutukset m päättävätn+EI3-.
Esimerkiksi natriumnitraatti3, Sen muodostavat Na -ionit+ ja ei3-. Tämä suola yhdessä kaliumnitraatin kanssa, kno3, ovat luonteeltaan runsaimpia nitraattien yksilöitä. Nitraatit löytyvät maaperästä, kasvikudoksista ja ennen kaikkea merien ja suolaliuoskerrostumien, kuten Salitre, joka sijaitsee Chilessä.
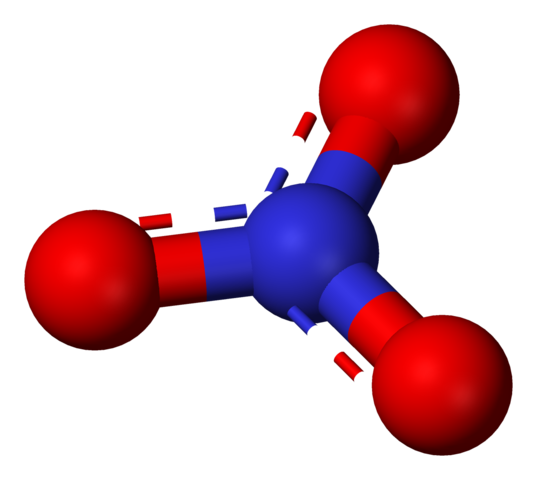
 Nitraatti -anioni, jota edustavat pallot ja baarimalli. Lähde: Benjah-BMM27 / julkinen verkkotunnus.
Nitraatti -anioni, jota edustavat pallot ja baarimalli. Lähde: Benjah-BMM27 / julkinen verkkotunnus. Termi 'nitraatit' viittaavat välittömästi suoloille, lannoitteille ja räjähteille. Ne liittyvät myös lihaan ja niiden kovetusprosesseihin estämään bakteerien kasvua ja siten viivästyttäen niiden heikkenemistä. Nitraatit ovat myös vihannesten synonyymejä, koska ne sisältävät suuria määriä näitä suoloja.
Hän ei3- (Ylivoimainen kuva) on typen hapetuin muoto, joka on sen biologisen syklin lopullinen ja omaksuva tuote. Ilmakehän typpi kärsii useista muutoksista joko sähkösäteiden työllä tai mikrobien kautta, jotta ne tulevat NH: sta4+ ja ei3-, molemmat liukenevat veteen ja kasveilla.
Nitraatteja käytetään hapettavina aineina, lannoitteina, räjähteinä ja kardiologisissa lääkkeissä. Tämä viimeinen käyttö on ristiriidassa muiden kanssa, koska ne metaboloivat tai ovat vuorovaikutuksessa kehon kanssa siten, että ne laajentavat suoneita ja valtimoita; Ja siksi verenvirtaus lisääntyy ja parantaa, mikä helpottaa sydänkipuja.
[TOC]
Nitraattien ominaisuudet
Puolueettomuus
Nitraatit ovat periaatteessa neutraaleja aineita, kuten ei3- Se on typpihapon konjugoitu emäs, HNO3, Vahva happo. Vedessä se ei ole tuntuvaa:
EI3- + H2Tai ⇌ hno3 + vai niin-
Itse asiassa voidaan sanoa, että tätä hydrolyysiä ei esiinny ollenkaan, OH: n halveksittavia määriä-. Siksi vesipitoiset nitraattiliuokset ovat neutraaleja, ellei ole muita liuenneita aineita.
Fyysiset esiintymiset
Epäorgaaniset nitraatit koostuvat suoloista, joiden yleiset kaavat ovat m (ei3-An, olemus n Se on metallisen kationin valencia tai positiivinen kuorma. Kaikilla näillä nitraateilla on kiteinen kirkkaus ja niissä on valkeahkoja värejä. Siirtymämetallit nitraatit voivat kuitenkin olla värikkäitä.
Esimerkiksi kuparinitraatti (II) tai kupricnitraatti, Cu (ei3-A2, Se on sinertävä kiteinen kiinteä. Samaan aikaan nikkelinitraatti (II) eikä (ei3-A2, Se on vankka smaragdin väri. Jotkut muut nitraatit, kuten rauta, esittävät heikkoja värejä.
Toisaalta orgaaniset nitraatit ovat yleensä erittäin herkkiä ja räjähtäviä kiinteitä aineita tai kiinteitä aineita.
Se voi palvella sinua: Elävä aine: Konsepti, ominaisuudet ja esimerkitLämpöhajoamisen
Metallitnitraatit ovat herkkiä korkeille lämpötiloille, koska ne alkavat hajottaa seuraavan kemiallisen yhtälön mukaan:
2m (ei3-A2(s) → 2 kuukautta (s)+4no2(g)+tai2(g)
Kuten havaittiin, metallitraatti hajoaa oksidiksi, MO: ksi ja typpi- ja happidioksidiksi. Tätä lämpöhajoamista ei tapahdu samassa lämpötilassa kaikille nitraateille; Jotkut vastustavat enemmän kuin toiset.
Pääsääntöisesti mitä suurempi ja pienempi kationin m kuorma on+, Suurempi on lämpötila, jossa nitraattia on lämmitettävä hajoamiseksi. Sen sijaan, kun m+ Se on pieni tai siinä on suuri positiivinen kuorma, nitraatti hajoaa alhaisemmissa lämpötiloissa, joten epävakaampi.
Esimerkiksi natriumnitraatti3, Se hajoaa lämpötilassa, joka on alhaisempi kuin bariumnitraatin, BA (ei3-A2, No, vaikka BA2+ on suurempi kuormitus kuin Na+, Sen koko on paljon suurempi.
Hapettava aine
Hän ei3- Se on suhteellisen vakaa anioni. Sen typpiatomi on kuitenkin voimakkaasti hapettunut, hapetustila on +5 (n5+JOMPIKUMPI32-), Joten se on elektronien "janoinen". Tästä syystä nitraatti on hapettava aine, joka pyrkii sieppaamaan aineet elektronit sen ympärille.
Juuri tämä elektronien puute ei3- Mitä nano tekee3 Ja Kno3 Vahvat hapettavat aineet, joita käytetään ruukukomponentteina. Tämän ominaisuuden lisääminen tosiasia, että kaasut vapautetaan2 Minä2 Hajottaessa ymmärretään, miksi se on osa monia räjähteitä.
Kun nitraatti saa elektroneja tai vähenee, se voidaan muuttaa ammoniakkiin, NH3, tai typpioksidissa, ei, reagenssista ja olosuhteista riippuen.
Liukoisuus
Kaikki epäorgaaniset nitraatit tai mikä on sama, metalli- ja ammoniumnitraatit, NH4EI3, Ne ovat vesiliukoisia yhdisteitä. Tämä johtuu siitä, että vesimolekyyleillä on vahva affiniteetti ei3-, Ja että näiden nitraattien kiteiset verkot eivät ole kovin vakaita.
Rakenne
Nitraattien anioni
 Nitraattiresonanssirakenteet. Lähde: Benjah-BMM27 / julkinen verkkotunnus.
Nitraattiresonanssirakenteet. Lähde: Benjah-BMM27 / julkinen verkkotunnus. Yläkuva näyttää nitraatti -anionin resonanssirakenteet. Kuten voidaan nähdä, kaksi negatiivista varausta sijaitsee kahdessa happiatomissa, jotka demokaalisoituvat kolmen happiatomin välillä. Siksi jokaisessa tai sen kuorma on -2/3, kun taas typellä on +1 -kuorma.
Joten ei3- Vuorovaikutus sähköstaatisesti tai muodostavat koordinaatioyhteyksiä minkä tahansa sen kolmesta happiatomista.
Kiintoaine
Kaikki epäorgaaniset nitraatit ovat suolaliuosta ja ionisia. Siksi sen rakenteet ovat kiteisiä, mikä tarkoittaa sen ionit, m+ ja ei3-, Ne on järjestetty avaruuteen heidän sähköstaattisen vuorovaikutuksensa ansiosta. Näistä vuorovaikutuksista riippuen niiden kiteet esittävät erilaisia rakenteita.
Voi palvella sinua: mikä on turvallisuusromu ja mihin se on?Esimerkiksi nanon kiteinen rakenne3 Se on trigonaalinen tai rhomboédica, kun taas kno3 Se on ortorrominen.
Orgaaniset nitraatit
Orgaaniset nitraatit on esitetty yleisen kaavan ronolla2, missä r on alkyyli- tai aromaattinen ryhmä. Näille yhdisteille on ominaista niiden R-AON-linkki2, ja koostuu yleensä polymeerien ja muiden orgaanisten aineiden typpiryhmää.
Kompleksi
Hän ei3- Se koordinoi metallikeskusten kanssa M -linkin muodostamiseksi+-TAI EI2-, Erilainen vuorovaikutus ioniseen. Nämä kompleksit ovat olennaisesti epäorgaanisia luonnetta. Nitraatti voidaan jopa koordinoida käyttämällä kahta sen happiatomia samanaikaisesti, M+-JOMPIKUMPI2EI.
Nimikkeistö
Nitraatin nimittämiseksi sanat 'nitraatti', jota seuraa kationin nimi tai ryhmä, joka liittyy siihen vastaavaan kemialliseen kaavaan, on ensin kirjoitettava. Kationin valencia on määritelty suluissa, kun sillä on useampi kuin yksi. Samoin jälkiliitteitä voidaan käyttää -co ja -oy, jos niin suositeltavia, perinteisen nimikkeistön seurauksena.
Harkitse esimerkiksi uskoa (ei3-A3. Sen nimi on rauta -nitraatti (III), koska sen valenssi on +3 tai sitä voidaan kutsua myös rauta -nitraatiksi.
Näitä sääntöjä sovelletaan myös orgaanisiin nitraatteihin, edellyttäen, että niiden rakenteet ovat yksinkertaisia. Esimerkiksi Cho3TAI EI2 Sitä kutsutaan metyylitraatiksi, koska -CH -ryhmä3 Siitä tulee R -ryhmä, joka seuraa -ono2.
Koulutus
Luonnollinen
Nitraatit muodostuvat luonnossa osana typen biologista sykliä. Tämän vuoksi maaperällä, merillä ja joillakin vesivirroilla on huomattavia määriä nitraatteja. Ympäröivistä ioneista riippuen muodostuu erilaisia nitraattien suoloja, jotka ovat nano3 Ja Kno3 Yleisin ja runsas.
Teollisuus-
Nitraatit muodostetaan teollisuusasteikolla neutraloimalla typpihappoa, joko metallihydroksideilla, alkoholilla, polymeereillä jne. Esimerkiksi kalsiumnitraatti, CA (ei3-A2, Se voidaan valmistaa seuraavan kemiallisen yhtälön mukaisesti:
CA (OH)2 + 2HNO3 → CA (ei3-A2 + 2H2JOMPIKUMPI
Samoin HNO hyökkää useita orgaanisia aineita3 Tietyissä olosuhteissa joidenkin ryhmien korvaamisen edistämiseksi -onolla2. Näin tapahtuu selluloosan reaktiolla muuttuvaksi nitroselluloosa- tai selluloosa -nitraatiksi, polymeeriksi ja räjähtäväksi materiaaliksi.
Fokatalyyttinen
Anionin ei3-, Ja siksi epäorgaaniset nitraatit voidaan muodostaa titaanioksidijätteen fotokatalyyttisellä vaikutuksella, setä2, Käyttämällä raaka -aineena muuta kuin typpeä ja ilman happea. Tässä tutkimuksessa oletetaan, että siellä missä on liiallista kaveria2, ei ole ei -toivottuja määriä ei3-, jotka vaikuttavat veden potentiaalisuuteen ja voivat sisältää leviä.
Voi palvella sinua: AldehydosSovellukset
Lihankovetus
 Makkarat ovat yksi jalostetuista lihoista, jotka sisältävät enemmän nitraatteja. Lähde: Pxhere.
Makkarat ovat yksi jalostetuista lihoista, jotka sisältävät enemmän nitraatteja. Lähde: Pxhere. Nitraatit lisätään useisiin lihaan, erityisesti makkaraan, bakteerien poistamiseksi ja siten niiden huonontumisen viivästymiseksi. He reagoivat myös proteiiniensa kanssa antaakseen heille punertavan värin. Näiden lihan ongelmana on, että keittämällä niitä korkeissa lämpötiloissa, ne tuottavat nitrosoamiineja: paksusuolen syöpään kytketyt yhdisteet.
Tätä reaktiota vältetään osittain, jos läsnä on vitamiineja, kuten vihannesten kohdalla, jotka vaikka ne ovat runsaasti nitraateissa, ei liity karsinogeenisiin patologioihin.
Maatalous
Nitraatit ovat liukoinen typpilähde. Siksi se toimii lannoitteena kasvien typen lisäämiseksi ja siten heidän kasvun suosimiseksi.
Lääke
Nitraateilla on erityinen toiminto kehossa. Kun assimiloitu entsymaattisella vaikutuksella, se pelkistetään typpioksidiksi, ei. Tämä molekyyli vie tilavuuden ja laajentaa suoneita ja valtimoita, jolloin verenvirtaus on suurempi. Siksi nitraatteja käytetään lääkkeinä verenkiertopatologioiden torjumiseksi.
Ironista ja uteliaana, tätä tarkoitusta varten on käytetty orgaanisia nitraatit, kuten glyserilo, nitroglyseriini, isosoridinen mononitraatti ja pentaeritritol -tetranitraattia, kaikkia hyviä ehdokkaita räjähteiden maailmassa.
Räjähteet
Nitraatteja käytetään räjähtävissä formulaatioissa, ruutia on symbolisin esimerkki. Hapettavia aineita, ne suosivat aineen palamista sen lisäksi, että tilavuus on äkillinen laajeneminen johtuen niiden kaasujen vapautumisesta hajoamisen jälkeen.
Esimerkkejä nitraateista
Edellisissä osissa on mainittu useampi kuin yksi esimerkki nitraateista. Lopuksi jotkut muut luetellaan yhdessä heidän kaavojensa ja nimiensä kanssa:
-Liinavaatteet3: Litiumnitraatti
-Rbno3: Rubidio nitraatti
-Mg (ei3-A2: Magnesiumnitraatti
-SC (ei3-A2: Skandion nitraatti
-Cr (ei3-A3: Kromitraatti (iii)
-Zn (ei3-A2: sinkin nitraatti
-PB (ei3-A2: Leadnitraatti (II)
-Agno3: hopeanitraatti
-CH3CH2TAI EI2: Etyylitraatti
-CH3(CH2-A4TAI EI2: Amilo Nitraatti
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Clark j. (5. kesäkuuta 2019). Nitraattien ja karbonaattien lämpöstabiilisuus. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Wikipedia. (2020). Nitraatti. Haettu: vuonna.Wikipedia.org
- Angela Dowden. (12. maaliskuuta 2019). Totuus ruokasi nitraateista. Haettu osoitteesta: BBC.com
- Elsevier B.V. (2020). Nitraatti. Tiede. Haettu: ScienEdirect.com
- DR. Biji S. Ja prof. Govindan V. (26. huhtikuuta 2017). Orgaanisten nitraattien rooli angina optimaalisessa lääketieteellisessä hoidossa. Eurooppalainen kardiologiayhdistys. Toipunut: Escardio.org
- Yuan, S., Chen, J., Lin, Z. et al. (2013). Nano-painettujen titaanidioksidin nitraattien muodostuminen ilmakehän typestä ja happea fotokatalysoitua. Nat -kommunikaatio 4, 2249. doi.org/10.1038/NCOMMS3249

