Massumero, mistä se koostuu ja miten se saa (esimerkkien kanssa)
- 4283
- 679
- Juan Breitenberg V
Hän Massamäärä o Atomin massamäärä on protonien lukumäärä ja ydinneutronien määrä. Nämä hiukkaset on nimetty vuorottelevasti nimen kanssa Nukleonit, Siksi massamäärä edustaa niiden määrää.
Olkoon n läsnä olevien neutronien lukumäärä ja z protonien lukumäärä, jos soitamme kuinka massamäärä, niin:
A = n + z
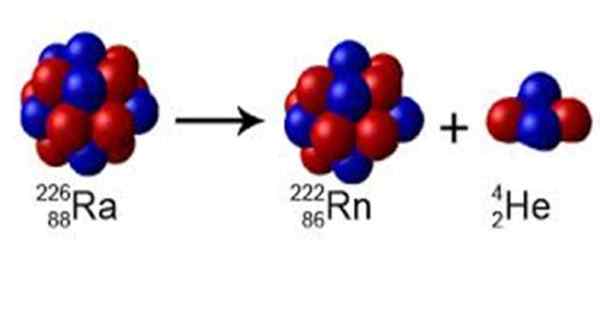
 Kuvio 1. Radiossa on massa numero A = 226, se hajoaa radoniin A = 222: lla ja emittoi a = 4: n heliumin ytimen. Lähde: Wikimedia Commons. Perox [CC0] [TOC]
Kuvio 1. Radiossa on massa numero A = 226, se hajoaa radoniin A = 222: lla ja emittoi a = 4: n heliumin ytimen. Lähde: Wikimedia Commons. Perox [CC0] [TOC]
Esimerkkejä massamääristä
Välittömästi joitain esimerkkejä hyvin tunnetuille elementeille:
Vety
Vakain ja runsas vetyatomi on myös yksinkertaisin: 1 protoni ja elektroni. Koska vety ytimessä ei ole neutroneja, on totta, että a = z = 1.
Happi
Hapen ytimessä on 8 neutronia ja 8 protonia, joten A = 16.
Hiili
Elämä maapallolla perustuu hiilikemiaan, valoatomiin, jossa on 6 protonia ytimessä ja 6 neutronia, kuten A = 6 + 6 = 12.
Uraani
Tämä raskas elementti kuin aikaisemmat, tunnetaan radioaktiivisista ominaisuuksistaan. Uraanin ytimessä on 92 protonia ja 146 neutronia. Sitten massamääräsi on A = 92 + 146 = 238.
Kuinka saada massinumero?
Kuten aiemmin sanottiin, elementin massamäärä A vastaa aina protonien lukumäärää ja sen ydintä sisältävien neutronien lukumäärää. Se on myös kokonaisluku, mutta ... onko molempien määrien välistä suhdetta mitään sääntöä?
Katsotaanpa: Kaikki yllä mainitut elementit ovat kevyitä, paitsi uraani. Vetyatomi on, kuten sanoimme, yksinkertaisin. Siinä ei ole neutroneja, ainakin runsaimmassa versiossa, ja happea ja hiiltä on olemassa yhtä suuri määrä protoneja ja neutroneja.
Se voi palvella sinua: mikä on päästöpyyhe? (Esimerkkejä)Sitä tapahtuu myös muiden kevyiden elementtien, kuten typen, toisen erittäin tärkeän elämän kaasun kanssa, jossa on 7 protonia ja 7 neutronia. Koska ydin on kuitenkin monimutkaisempi ja atomit muuttuvat raskaammiksi, neutronien lukumäärä kasvaa toisen rytmin kanssa.
Toisin kuin kevyet elementit, uraanilla, jossa on 92 protonia.5 x 92 = 138.
Kuten näette, se on melko lähellä 146, sen neutronien määrä.
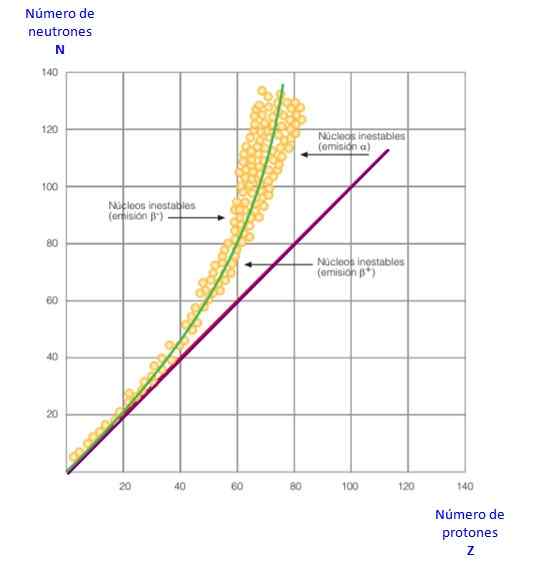 Kuva 2. Vakauskäyrä. Lähde: f. Zapata.
Kuva 2. Vakauskäyrä. Lähde: f. Zapata. Kaikki tämä käy ilmi kuvan 2 käyrässä. Se on kuvaaja n verrattuna z, joka tunnetaan nimellä ydinvakauskäyrä. Siellä voidaan nähdä, kuinka valoatomeilla on sama määrä protoneja kuin neutronia ja kuinka Z = 20 neutronien lukumäärä kasvaa.
Tällä tavoin iso atomi muuttuu vakaammaksi, koska ylimääräiset neutronit vähentävät protonien välistä sähköstaattista torjumista.
Atomien merkintä
Erittäin hyödyllinen merkintä, joka kuvaa nopeasti atomin tyyppiä, on seuraava: elementin symboli ja vastaava atomi- ja massaluettelot kirjoitetaan tässä järjestelmässä alla esitetyllä tavalla:
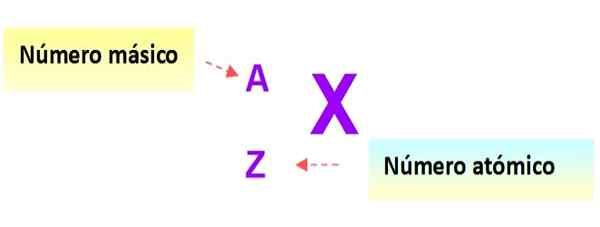 Kuva 3. Atomi -merkintä. Lähde: f. Zapata.
Kuva 3. Atomi -merkintä. Lähde: f. Zapata. Tässä merkinnässä aikaisempien esimerkkien atomit olisivat:

Joskus käytetään toista mukavampaa merkintää, jossa käytetään vain elementin symbolia ja massa -numeroa atomin merkitsemiseksi, atominumeron jättäminen pois. Tällä tavalla 12 6C on kirjoitettu yksinkertaisesti hiili-12, 16 8Tai se olisi happea-16 ja niin jokaiselle elementille.
Voi palvella sinua: Puolipyöreä: Kuinka laskea kehä, pinta -ala, keskimmäinen, harjoituksetIsotoopit
Ytimen protonien lukumäärä määrittää elementin luonteen. Esimerkiksi jokainen atomi, jonka ydin sisältää 29 protonia, on kupariatomi, mitä tapahtuu.
Oletetaan, että kupariatomi menettää elektronin mistä tahansa syystä, mutta se on silti kuparia. Nyt se on kuitenkin ionisoitu atomi.
Atomi -ytimen on vaikeampaa voittaa tai menettää protonia, mutta luonnossa se voi tapahtua. Esimerkiksi tähtien sisällä muodostetaan jatkuvasti raskaampia elementtejä kevyistä elementeistä, koska tähden ydin käyttäytyy kuin fuusioreaktori.
Ja täällä maan päällä on ilmiö radioaktiivinen hajoaminen, jossa jotkut epävakaat atomit karkottavat nukleonit ja lähettävät energiaa muuttuen muiksi elementeiksi.
Lopuksi on mahdollista, että tietyn elementin atomilla on erilainen massumäärä, tässä tapauksessa se on a isotooppi.
Hyvä esimerkki on tunnettu hiili-14 tai radiohiili, jota käytetään tähän mennessä arkeologisiin esineisiin ja biokemiallisena merkkiaineena. Tämä on sama hiili, jolla on identtiset kemialliset ominaisuudet, mutta kahdella ylimääräisellä neutronilla.
Hiili-14 on vähemmän runsaasti kuin hiili-12, stabiili isotooppi ja on myös radioaktiivinen. Tämä tarkoittaa, että ajan myötä se hajoaa lähettämällä energiaa ja hiukkasia, kunnes siitä tulee vakaa elementti, mikä on typpi.
Hiili -isotoopit
Hiili on luonteeltaan useiden isotooppien seoksena, joista runsain on edellä mainittu 12 6C tai hiili-12. Ja hiili-14 on lisäksi 13 6C ylimääräisen neutronin kanssa.
Voi palvella sinua: vaihtovirtapiirit: tyypit, sovellukset, esimerkitTämä on luonteeltaan yleistä, esimerkiksi tinasta, 10 stabiilia isotoopia tunnetaan. Toisaalta yksi isotooppi tunnetaan nimellä beryllium ja natrium.
Jokaisella isotoopilla, luonnollinen tai keinotekoinen on erilainen muutosrytmi. Samoin on mahdollista luoda keinotekoisia isotooppeja laboratoriossa, jotka ovat yleensä epävakaita ja rappeutuvia radioaktiivisesti hyvin lyhyessä sekunnissa, kun taas toiset vievät paljon enemmän, yhtä paljon kuin maan ikä tai enemmän.
Luonnollinen hiilen isotooppipöytä
| Hiili -isotoopit | Atominumero z | Massa numero A | Yltäkylläisyys % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.yksitoista |
| 14 6 C | 6 | 14 | Jäljet |
Ratkaistu esimerkki
- Esimerkki 1
Mikä on ero välillä 13 7 N ja 14 7 N?
Vastaus
Molemmat ovat typpiatomeja, koska niiden atomiluku on 7. Yhdellä isotoopeista, jolla on A = 13, on kuitenkin vähemmän neutronia, kun taas 14 7 N on runsain isotooppi.
- Esimerkki 2
Kuinka monta neutronia on elohopeaatomin ytimessä, merkitty 201 80 Hg?
Vastaus
Koska A = 201 ja Z = 80, ja myös tietäen sen:
A = z + n
N = a - z = 201 - 80 = 121
Ja päätellään, että elohopeaatomilla on 121 neutronia.
Viitteet
- Connor, n. Mikä on nukleoni - atomien ytimen rakenne - määritelmä. Haettu: jaksollisesta-rable.org.
- Ritari, r. 2017. Tutkijoiden fysiikka ja tekniikka: strategialähestymistapa. Pearson.
- Sears, Zemansky. 2016. Yliopiston fysiikka, jolla on moderni fysiikka. 14. päivä. Ed. Nide 2.
- Tippens, P. 2011. Fysiikka: Käsitteet ja sovellukset. 7. painos. McGraw Hill.
- Wikipedia. Massamäärä. Haettu: vuonna.Wikipedia.org.
- « Magnesiumnitraatti (Mg (NO3) 2) rakenne, ominaisuudet, käyttää
- Coplanares -pisteyhtälö, esimerkki ja ratkaistu harjoitus »

