Nukleofiilinen nukleofiilinen hyökkäys, tyypit, esimerkit, nukleofiilisyys
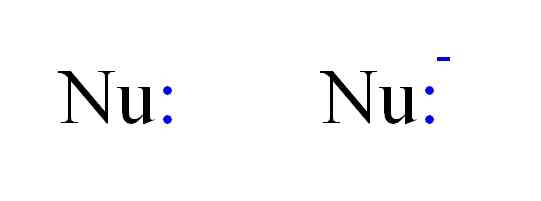
- 3073
- 448
- Dr. Travis Reichert
Eräs nukleofiili Kaikki atomi, ioni tai molekyyli pyrkii luovuttamaan elektroniparit positiivisilla kuormituksilla tai alueilla. Sana tarkoittaa 'rakkautta ytimiin'. Kun atomi tai molekyylialue on heikko elektroneissa, se kokee atomiykkeiden suuremman vetovoiman voiman; Ja juuri tämä vetovoima houkuttelee nukleofiilejä.
Siksi nukleofiilien on oltava vastakkaisia merkkejä, nukleofiilien on oltava negatiivisia lajeja; tai ainakin erittäin negatiivisten alueiden hallussapito paikallisen tai hajallaan olevan elektronipitoisuuden vuoksi.
 Kemian kaksi yleisimmin nukleofiliatyyppiä. Lähde: Gabriel Bolívar.
Kemian kaksi yleisimmin nukleofiliatyyppiä. Lähde: Gabriel Bolívar. Siten NU -kirjaimet voidaan edustaa nukleofiiliä, kuten yllä olevassa kuvassa. Kaksinkertaiset pisteet sinisellä vastaavat pari elektronia, jotka lahjoittavat elektrofiilille; Tämä on atomi tai huono elektronimolekyyli. Huomaa, että nukleofiili voi olla neutraali tai anioninen, mutta molemmat lahjoittavat elektroniparit.
Nukleofiilien hyökkäys elektrofiileihin on lukemattomien reaktioiden ja orgaanisten mekanismien kulmakivi. Esimerkki nukleofiilistä on hydroksyylianioni, OH-, joka myös käyttäytyy perustana. Nukleofiilisyyttä ei kuitenkaan tule koskaan sekoittaa aineen emäksisyyteen.
[TOC]
Nukleofiilinen hyökkäys
Nukleofiilit näyttävät. Seuraava kemiallinen yhtälö edustaa nukleofiilihyökkäystä:
Gnuu- + R-LG → R-NU + LG-
Nukleofiili NU: Lahjoittaa sen elektronien parin A R, joka on kytketty elektronegatiiviseen LG -ryhmään. Näin toimiessaan R-LG-linkki on rikki, LG: n EMIGRA: ja uusi R-NU-linkki on muodostettu. Tämä on perusta monille orgaanisille reaktioille.
Seuraavassa osassa nähdään, että nukleofiili voi olla jopa aromaattinen rengas, jonka elektroninen tiheys on dispergoitunut sen keskukseen. Samoin nukleofiilistä voi tulla sigma -sidos, mikä tarkoittaa, että saman muuttaneen elektronit tai hyppäävät läheisiin ytimiin.
Voi palvella sinua: kaliumkromaatti (k2cro4)Nukleofiilien tyypit
Nukleofiilejä on useita tyyppejä, mutta valtava pääaine.
Lajit, joilla on vapaat elektroniparit
Kun puhumme lajeista, joilla on vapaat elektroniparit, viitataan anioneihin tai molekyyleihin, joissa on elektronegatiivisia atomeja, kuten happea, typpeä ja rikkiä. Esimerkkejä osassa monia tämän tyyppisiä nukleofileja nähdään, lukuun ottamatta anionia OH- jo mainittu.
Kaksoislinkit
Nukleofiilillä voi olla kaksoissidoksia, jotka ovat vastuussa nukleofiilisestä hyökkäyksestä. Niiden on kuitenkin oltava kaksoissidoksia, joilla on huomattava elektroninen tiheys, joten mitään niiden hallussa olevaa molekyyliä pidetään vahvana nukleofiilinä; toisin sanoen sillä ei ole korkeaa nukleofiilisyyttä.
Tarkastellaan esimerkiksi bentseenirengasta seuraavassa alkyloinnin reaktiossa (Friedel-Crafts-reaktio):
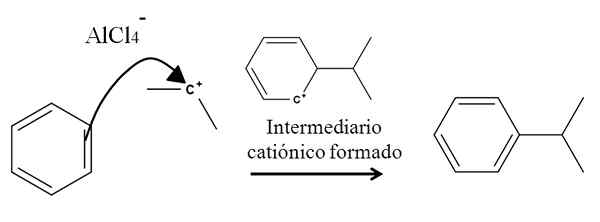 Bentseenialkylointi aromaattisessa elektrofiilisessä substituutiossa. Lähde: Gabriel Bolívar.
Bentseenialkylointi aromaattisessa elektrofiilisessä substituutiossa. Lähde: Gabriel Bolívar. ALCL -seoksen läsnäolo3-(CH3-A2CHCL on peräisin isopropyylikarbokaatiosta. Sen positiivinen kuorma ja epävakaus houkuttelee voimakkaasti yhden bentseenin kaksoissidoksen elektroneja, jotka hyökkäävät Carbocationiin, kuten nuoli edustaa.
Prosessissa muodostuu lyhyt kationinen ja aromaattinen toukokuu, joka lopulta muuttuu oikeaan tuotteeseen.
Bentseenin lisäksi muut kaksoissidoksissa olevat aineet voivat toimia nukleofiileinä, edellyttäen, että reaktio -olosuhteet ovat sopivimmat. Samoin on oltava atomeja, jotka sijaitsevat lähellä kaksoissidosta, jotka lahjoittavat elektronisen tiheyden, niin että ne "latautuvat" elektroneja.
Sigmasilinkit
Sigma -sidokset sellaisenaan eivät ole nukleofileja; Mutta se voi toimia sellaisenaan, kun reaktio alkaa ja mekanismi alkaa. Mieti seuraavaa esimerkkiä:
Se voi palvella sinua: Linding Suolat: Mitä ovat, nimikkeistö, ominaisuudet, esimerkit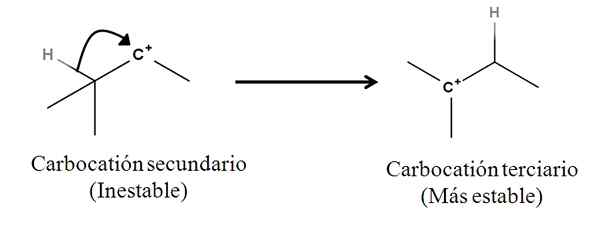 Kolmannen asteen hiilikerroksen sekundaarin muuntaminen siirtymällä hydridianionista. Lähde: Gabriel Bolívar.
Kolmannen asteen hiilikerroksen sekundaarin muuntaminen siirtymällä hydridianionista. Lähde: Gabriel Bolívar. Carbocationin vieressä oleva Sigma C-H -sidos liikkuu kohti häntä käyttäytyvän kuin nukleofiili (katso kaarevan nuolen liike). Tässä mielessä seurauksena on, että anioni H liikkuu- Naapurihiilelle, mutta niin nopeasti, että Sigma -sidos ja sen elektronipari tämän mekanismin nukleofiilisenä aineena otetaan huomioon.
Nukleofiiliesimerkit
Tässä osassa mainitaan useita esimerkkejä ensimmäisistä nukleofilien tyypistä, jotka ovat erittäin runsaasti ja tärkeitä orgaanisessa ja epäorgaanisessa kemiassa.
Halogeeniros
Halogeenurot (f-, Cl-, Br- ja minä-) Ne ovat nukleofiilejä. Täytyy lahjoittaa yksi heidän neljästä heidän valenssielektroniparista. Riippuen nopeudesta, jolla yksi näistä halogenurosista hyökkää sähköfektofialle, on suurempi tai pienempi nukleofiilisyys.
Yleensä i- Se on parempi nukleofiili kuin F- ja muut halogeenurot, koska kovalenttisen linkin muodostaminen on helpompaa, koska se on polarisoitavampi; Eli tilaa vievämpi ja vähemmän sitkeys luopua elektroniparista.
Elektronegatiiviset atomimolekyylit
 Vesimolekyylit
Vesimolekyylit Vesi, hah, on nukleofiili, koska happiatomilla on korkea negatiivinen tiheys ja vapaat elektroniparit lahjoittaa ja muodostaa kovalenttisen sidoksen. Myös alkoholit, Roh, ovat nukleofiilejä samoista syistä kuin veden.
Pienet typpimolekyylit, kuten ammoniakki, NH3, Heillä on taipumus olla myös nukleofiilejä. Tämä johtuu siitä, että typpi voi luovuttaa yksinäisen elektroniparinsa. Samoin amiinit, RNH2, Ne ovat myös nukleofileja.
Ja pienten molekyylien lisäksi, joilla on happea tai typpeä, rinnat lasketaan myös nukleofileiksi. Näin on rikkivety, H2S ja tioles, rsh.
Rikki on parempi nukleofiili kuin happi ja typpi, koska se on vähemmän "tarttuminen" sen elektronipariin, joten se on helpompi luovuttaa. Tätä varten on myös lisättävä, että sen atomi on laajempi, ts. Polarisoitavampi ja siksi kykenevä muodostamaan kovalenttisia sidoksia vähemmän vaikeuksissa.
Se voi palvella sinua: Mohr -menetelmä: Perusteet, reaktiot, menettely, käyttöAnionit
Hapetettuja, typpeä, rikkipohjaisia anioneja, ja yleensä useat niistä ovat vahvoja nukleofileja. Tämä johtuu siitä, että heillä on nyt negatiivinen kuorma, joka vahvistaa edelleen heidän lahjoittamiensa elektroniparin läsnäoloa.
Harkitse esimerkiksi seuraavia anioneja, jotka on asetettu vähentävään nukleofiilisyyden järjestykseen:
: Ch3- >: NH2- >: Voi- >: F-
Hiilihiiliohjaus ch3- Se on voimakkain nukleofili, koska hiiliatomi ei stabiloi negatiivista kuormaa, jonka elektronit ovat "epätoivoisia" lähellä olevia ytimiä. Tätä ei tapahdu Amiduron, NH: n kanssa2-, joiden typpiatomi stabiloi paremmin negatiivisen kuorman ja tuottaa elektroniparin helpommin kuin OH- tai f-.
Nukleofiilisyys
Nukleofiilisyys määrittelee, kuinka vahva lajin nukleofiili luonne on. Tämä riippuu monista tekijöistä, mutta tärkeimmät ovat steerinen este nukleofiilisen hyökkäyksen ja liuottimen vaikutuksen aikana.
Mitä pienempi nukleofiili, sitä nopeampi ja tehokas se on elektrofiilihyökkäys. Lisäksi kuinka paljon alhaisempi liuottimen ja nukleofiilin väliset vuorovaikutukset. Siksi tämän mukaan I- on suurempi nukleofiilisyys kuin F-.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10. painos.-A. Wiley Plus.
- James Ashenhurst. (2020). Nukleofiilien kolme luokkaa. Toipunut: MasterorganicChemistry.com
- Professori Patricia Shaley. (2012). Nukleofiilit ja elektrofiilit. Illinoisin yliopisto. Toipunut: butaani.Kemia.Uic.Edu
- Wikipedia. (2020). Nukleofiili. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (11. helmikuuta 2020). Nukleofiilin määritelmä kemiassa. Toipunut: Admingco.com
- Rachael Curtis. (5. kesäkuuta 2019). Nukleofiili. Kemian librettexts. Palautettu: Chem.Librettexts.org
- « Termodynaamiset järjestelmän ominaisuudet, tyypit, esimerkit
- Tasa -arvoinen kertoja käsite, ominaisuudet ja esimerkit »

