Kalsiumoksalaatti (CAC2O4) ominaisuudet, rakenne, käyttö, riskit
- 4787
- 1295
- Mr. Clifford Kshlerin
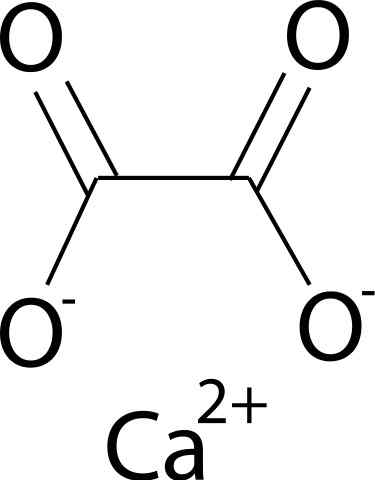
Hän Kalsiumoksalaatti Se on orgaaninen yhdiste, joka on muodostanut hiili (C), happi (O) ja kalsium (CA) elementit (CA) (CA). Sen kemiallinen kaava on CAC2JOMPIKUMPI4. Sitä löytyy yleensä sen kolmesta hydratoitua muotoa: mono-, di- ja trihydraatti. Tämä on yhden, kahden tai kolmen vesimolekyylin kanssa sen kiteisessä rakenteessaan.
Kalsiumoksalaattia löytyy mineraaleista, kasveista, sienistä ja muista elävistä olennoista, kuten nisäkkäistä ja jopa ihmisistä joidenkin proteiinien aineenvaihdunnan seurauksena. Sitä löytyy ihmisten ja joidenkin eläinten virtsasta.
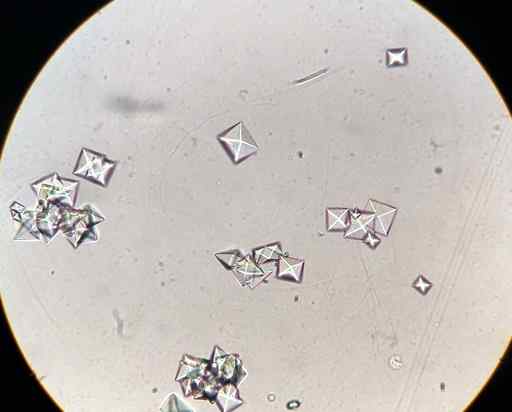 CAC -kalsiumoksalaattikiteitä2JOMPIKUMPI4 Mikroskoopilla havaittu virtsanäyte. J3D3/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
CAC -kalsiumoksalaattikiteitä2JOMPIKUMPI4 Mikroskoopilla havaittu virtsanäyte. J3D3/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Jotkut ruuat, kuten pinaatti, rubarbos, soija.
Voit välttää CAC -kivien ulkonäön2JOMPIKUMPI4 Munuaisissa, jos monia nesteitä nautitaan, etenkin vettä, välttäen ruokia, joilla on korkea oksalaattipitoisuus ja kuluttavat rikkaat kalsiumissa ja magnesiumissa.
Kalsiumoksalaatti muodostaa ei -toivottuja putkien ja prosessisäiliöiden, kuten massan ja paperinvalmistuksen, ja myös olutta tehtaissa.
[TOC]
Rakenne
Kalsiumoksalaatti muodostuu kalsiumin ca -ionilla2+ ja oksalaatti -ioni C2JOMPIKUMPI42-. Oksalaattianioni koostuu kahdesta hiiliatomista ja neljästä happiatomista. Oksalaattianionin negatiiviset kuormat löytyvät happiatomeista.
 Kalsiumoksalaatin kemiallinen rakenne. Vsimonian/cc by-Sa (https: // creativecommons.Org/lisenssit/by-SA/2.5). Lähde: Wikimedia Commons.
Kalsiumoksalaatin kemiallinen rakenne. Vsimonian/cc by-Sa (https: // creativecommons.Org/lisenssit/by-SA/2.5). Lähde: Wikimedia Commons. Nimikkeistö
- Kalsiumoksalaatti
- Oksaalihapon kalsiumsuola
- Etanodioiinihappo kalsiumsuola
Ominaisuudet
Fyysinen tila
Väritön kiteinen, valkoinen, keltainen tai ruskea, joka voi olla kolmessa eri hydratoitussa muodossa.
Molekyylipaino
128,1 g/mol
Sulamispiste
Kalsiumoksalaattimonohydraatti hajoaa 200 ° C: seen.
Tietty paino
Cac -monohydraatti2JOMPIKUMPI4 •H2O = 2,22 g/cm3
Cac -dihydraatti2JOMPIKUMPI4 •2H2O = 1,94 g/cm3
Kac -trihydraatti2JOMPIKUMPI4 •3H2O = 1,87 g/cm3
Liukoisuus
Lähes liukenematon veteen: 0,00061 g/100 g vettä 20 ° C: ssa. Monohydraatti liukenee laimennettuun happoon.
PHE
Vesipitoiset kalsiumoksalaattiliuokset ovat heikosti emäksisiä.
Kemialliset ominaisuudet
Kalsiumoksalaatti on oksaalihapon kalsiumsuola. Tämä on aineenvaihdunnan luonnollinen toissijainen tuote, joten se on erittäin runsaasti ihmiskehossa ja on osa monia ruokia.
Oksaalihappo ja sen konjugoitu emäs, oksalaatti, ovat erittäin hapettuneita orgaanisia yhdisteitä, joilla on voimakas kelatoiva aktiivisuus, ts. Ne voidaan helposti yhdistää positiivisiin ioneihin +2 tai +3 kuormituksella.
Voi palvella sinua: metyyli- tai metalo -ryhmäSen vesipitoiset liuokset ovat heikosti emäksisiä, koska oksalaatti -ionilla on taipumus ottaa protoneja H+ vettä, joka vapauttaa OH -ionit-. Kun olet ottanut kaksi protonia H+ Oksalaatti -ionista tulee oksaalihappo H2C2JOMPIKUMPI4-
C2JOMPIKUMPI42- + H2O → HC2JOMPIKUMPI4- + vai niin-
HC2JOMPIKUMPI4- + H2O → h2C2JOMPIKUMPI4 + vai niin-
Läsnäolo luonnossa
Mineraaleissa
Kalsiumoksalaatti on yleisin oksalaatti ja se esitetään mineraalien muodossa, nimeltään Whewellita, Weddellita ja Caoksiitti.
Whewellita on CAC -monohydraatti2JOMPIKUMPI4 •H2Tai ja on vakain tämän yhdisteen muodoista.
 Whewellita Mineral Rock. Rob Lavinsky, Irocks.com-cc-by-sa-3.0/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons.
Whewellita Mineral Rock. Rob Lavinsky, Irocks.com-cc-by-sa-3.0/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons. Weddellita on CAC -dihydraatti2JOMPIKUMPI4 •2H2O ja on vähemmän vakaa kuin monohydraatti.
 Weddelite Mineral Crystals. Leon Hupperichs/CC by (https: // creativecommons.Org/lisenssit/by/3.0). Lähde: Wikimedia Commons.
Weddelite Mineral Crystals. Leon Hupperichs/CC by (https: // creativecommons.Org/lisenssit/by/3.0). Lähde: Wikimedia Commons. Caxita on kalsiumoksalaattisen trihydrado -cac2JOMPIKUMPI4 •3H2JOMPIKUMPI.
Kasveissa ja sienissä
Kalsiumoksalaatti liittyy kuiviin maaperään ja lehtiin, myös patogeeneihin, vapaisiin, symbioosiin tai kasveihin liittyvät kasvit. Jälkimmäisessä kiteitä muodostetaan kalsiumin saostamisella sen oksalaatin muodossa.
CAC -muodostuminen2JOMPIKUMPI4 Sienille sillä on tärkeä vaikutus maaperän biologisiin ja geokemiallisiin prosesseihin, koska se muodostaa kalsiumvarannon ekosysteemille.
Läsnäolo ihmiskehossa ja nisäkkäissä
Oksalaatti on peräisin maksasta, punaisista tai punaisista verisoluista ja pienemmässä määrin munuaisissa. Se muodostuu aminohappojen (kuten fenyylialaniinin ja tryptofaanin) aineenvaihdunnasta ja glioxal -dialdehydin hapetuksella,.
C -vitamiinista voi myös tulla oksalaattia suoritettaessa sen antioksidanttitoimintaa.
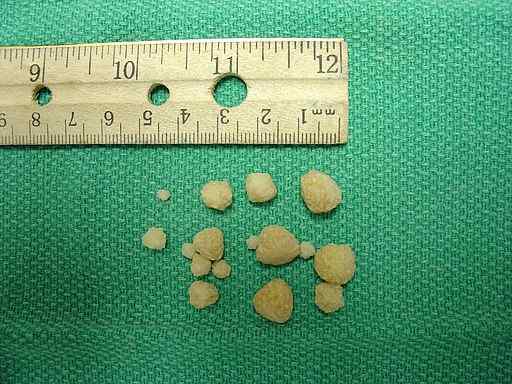
Kalsiumoksalaattia löytyy kivistä, jotka muodostuvat munuaissairauksien munuaisissa tai eläimissä.
SO: n nimeämät kalsiumoksalaattilaskelmat tai kivet muodostetaan CAC: n kiteyttämisellä tai aggregaatiolla2JOMPIKUMPI4 Koko virtsassa kalsiumin ja oksalaatin kanssa. Tämä tarkoittaa, että virtsa sisältää sekä kalsiumia että oksalaattia, että ei ole mahdollista, että mainittu yhdiste pysyy liuenneena, mutta saostuu tai kulkee kiinteään tilaan kiteiden muodossa.
Ihmisillä
Munuaisten hiekan tai kivien muodostuminen on nefrolitiaasi -niminen sairaus; Se hyökkää noin 10% populaatiosta ja noin 75% näistä kivistä koostuu kalsiumoksalaattisesta CAC: sta2JOMPIKUMPI4.
 Kalsiumoksalaatti voi muodostaa kiviä munuaisissa. Kirjoittaja: vsrao. Lähde: Pixabay.
Kalsiumoksalaatti voi muodostaa kiviä munuaisissa. Kirjoittaja: vsrao. Lähde: Pixabay. Kalsiumoksalaattikiteiden muodostuminen ja kasvu munuaisessa tapahtuu, koska joissakin ihmisissä virtsa on tyydyttynyt mainitulla suolalla. Kalsiumoksalaatti kehittyy happovirtsassa pH: ssa alle 6,0.
Voi palvella sinua: IsóbarosYläasennus tapahtuu, kun tämän suolan erittyminen tai eliminointi (joka on hyvin vähän liukenevaa veteen) virtsan läpi tapahtuu pienessä vesimäärässä.
Munuaiskivien ulkonäköön vaikuttavat tekijät
Kalsiumoksalaattihiekan muodostumista suosivista tekijöistä ovat ylimääräinen kalsium virtsassa tai hyperkalkiuriassa, liiallinen oksalaatti virtsassa tai hyperoksaluriassa, ruokinnasta johdetut elementit ja estäjien puuttuminen.
Ylimääräinen oksalaatti voi tapahtua, kun suuria määriä pinaattia, karkeaa, soijaa, pähkinää ja suklaata nautitaan muun muassa.
 Suklaa voi olla kalsiumoksalaatin lähde ja kannattaa kivien ulkonäköä munuaisissa. Kirjoittaja: Alexander Stein. Lähde: Pixabay.
Suklaa voi olla kalsiumoksalaatin lähde ja kannattaa kivien ulkonäköä munuaisissa. Kirjoittaja: Alexander Stein. Lähde: Pixabay. On kuitenkin aineita, jotka estävät tai estävät kivien muodostumista. Laskelmia välttävät yhdisteet ovat pienet molekyylit, kuten sitraatti ja pyrofosfaatti, ja suuret molekyylit, kuten glykoproteiinit ja proteoglykaanit.
Tapoja välttää kalsiumoksalaattikivien muodostumista
Hyvä strategia hiekan toistumisen tai kalsiumoksalaattlaskelmien estämiseksi, mukaan lukien nesteiden nauttimisen lisääntyminen, kalsiumrikkaita elintarvikkeiden (kuten maitotuotteet) lisääntyminen ja taulukon suola (NACl), eläinproteiini, eläinproteiini ja rikkaat ateriat oksalaatissa.
Eläimissä
Vuoden alusta 2000. Vaikuttaa siltä, että tämä riippuu näiden eläinten nauttivasta ruoan tyypistä ja liittyy virtsan ja magnesiumvajeen happamuuteen (MG).
 Kalsiumoksalaattikivet, joita löytyy koiran virtsarakosta. Joel Mills/CC BY-SA (http: // creativecommons.Org/lisenssit/by-SA/3.0/). Lähde: Wikimedia Commons.
Kalsiumoksalaattikivet, joita löytyy koiran virtsarakosta. Joel Mills/CC BY-SA (http: // creativecommons.Org/lisenssit/by-SA/3.0/). Lähde: Wikimedia Commons. Kehon vaste ylimääräiselle oksalaatille
On näyttöä siitä, että sekä ihmiset että eläimet reagoivat ylimääräiseen oksalaattiin lisäämällä bakteerien lukumäärää, jotka voivat heikentää oksalaattia.
Jotkut näistä bakteereista ovat Oksalobacter formigeenit, Bifidobacterium SP., Porfyromonas gingivalis ja Bacillus sp., muun muassa ja ovat läsnä luonnollisesti suolistossa.
Sovellukset
Kuultujen lähteiden mukaan kalsiumoksalaattia käytetään keraamisessa pinnoitteessa.
Sitä on käytetty peittämään veistoksia ja muita kalkkikiven taiteellisia elementtejä, ja on havaittu, että se parantaa materiaalin kovuutta, vähentää huokoisuuttaan ja lisää sen vastustuskykyä hapoille ja alkalille.
 Italiassa on koettu kattamaan museoiden kalkkikivi kalsiumoksalaatilla niiden säilyttämiseksi. Kirjoittaja: Lähde: Moni Quayle. Pixabay.
Italiassa on koettu kattamaan museoiden kalkkikivi kalsiumoksalaatilla niiden säilyttämiseksi. Kirjoittaja: Lähde: Moni Quayle. Pixabay. Joissakin prosesseissa
Massan ja paperiteollisuuden kalsiumoksalaatti voi muodostaa tuloja, jotka aiheuttavat monia ongelmia prosessissa.
Sen muodostumisen välttämiseksi teollisuusprosessikanavissa tai putkissa.
Se voi palvella sinua: kobolttikloridi (cocl2 (: rakenne, nimikkeistö, ominaisuudetSillä on taipumus kertyä kiveksi astioissa, joissa olutta valmistetaan, missä se on eliminoida mikro -organismien muodostumisen välttämiseksi, jotka voivat antaa epämiellyttävän maun juomiseen.
Riskejä
Korkeissa pitoisuuksissa oksalaatti voi aiheuttaa kuoleman eläimissä ja toisinaan ihmisillä pääasiassa sen syövyttävien vaikutusten vuoksi.
Oksalaatin ja sen konjugoidun hapon kertyminen, oksaalihappo, voi aiheuttaa häiriöitä, kuten sydämen toimintahäiriöitä, kalsiumoksalaattikiviä, munuaisten vajaatoimintaa ja jopa kuoleman toksisuudesta.
Viitteet
- Glasauer, S.M. et al. (2013). Metallit ja metalloidit, muutos mikro -organismeilla. Oksalaatit. Viitemodulaatiossa maajärjestelmissä ja ympäristötieteissä. ScienEdirect.com.
- Baumann, J. M. ja Casella, r. (2019). Kalsium nefrolitiaasin ehkäisy: diureesin vaikutus kalsiumoksalaatin kiteytymiseen virtsassa. Adv Previum, 2019; 2019: 3234867. NCBI toipunut.Nlm.NIH.Hallitus.
- Breshears, m.-Lla. ja antaa,.W -. (2017). Virtsajärjestelmä. Kalsiumoksalaatti. Eläinlääketieteen patologisesti (kuudes painos). ScienEdirect.com.
- Huang, ja. er al. (2019). Oksalaatin TGE: n käsittely TGE -rungossa ja oksalaatin TGE: n alkuperässä kalsiumoksalaattihutkessa. Urol Int, 2019 5. joulukuuta: 1-10. NCBI toipunut.Nlm.NIH.Hallitus.
- Nilvebrant, n.-JOMPIKUMPI. et al. (2002). Bioteknologia massan ja paperiteollisuudessa. Bioteknologian käynnissä. ScienEdirect.com.
- Pahira, J.J -. Ja Pevzner, M. (2007). Nefrolitiaasi. Kalsiumkivet. Pennin kliinisessä urologian käsikirjassa. ScienEdirect.com.
- Worcester, E. M. (1994). Virtsan kalsiumoksalaattikiteiden kasvun estäjät. J Am Soc Nephrol 1994 marraskuu; 5 (5 Suppl 1): S46-53). Palautettu Jasnista.Asunnot.org.
- Finkielstein, V.-Lla. ja Goldfarb, D.S. (2006). Strategiat kalsiumoksalaattikivien estämiseksi. NCBI toipunut.Nlm.NIH.Hallitus.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Kalsiumoksalaatti. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Aukko, a.B -. et al. (2015). Oksalaatin häviävät mikro-organismit tai oksalaatin häviävät entsyymit: WICH on tulevaisuudenhoito toistuvien kivisairauksien kalsiumoksalaattien entsymaattiselle liukenemiselle? Urolithiasis, 2016 helmikuu; 44 (1): 27-32. NCBI toipunut.Nlm.NIH.Hallitus.
- Pyhät, r.P. et al. (2016). Virtsan oksalaatin erittymisen alentaminen kalsiumoksalaatin kivikive -dieparin asettamiseksi. Urolitiaasi. 2016 helmikuu; 44 (1); 27-32. NCBI toipunut.Nlm.NIH.Hallitus.
- Cyzar, t.M. (1998). Kalsiumoksalaatti: Kalkkikiven pintakäsittely. Journal of Conservation and Museum Studies 4, s.6-10. Haettu JCMS-Journalista.com.
- Wikimedia (2019). Kalsiumoksalaatti. Haettu jstk.Wikipedia.org.
- « Laadulliset tutkimusominaisuudet, tyypit, tekniikat, esimerkit
- Funktionalismi (psykologia) alkuperä, ominaisuudet ja kirjoittajien edustajat »

