Natriumoksalaatti (NA2C2O4) rakenne, ominaisuudet, käytöt, riskit

- 2581
- 94
- Arthur Terry II
Hän natriumoksalaatti Se on orgaaninen yhdiste, joka on muodostettu kahdella natriumionilla ja oksalaatti -ionilla. Sen kemiallinen kaava on Na2C2JOMPIKUMPI4 tai myös na2(KUJERTAA)2. Se on oksaalihapon tai etanodiomiinihapon natriumsuola. Sitten eräs2C2JOMPIKUMPI4 Se on kiteinen valkoinen kiinteä ja sen vesiliuokset ovat emäksisiä (alkali).
Natriumoksalaattia on läsnä kasveissa ja vihanneksissa. Ihmisessä se syntyy luonnollisesti sen konjugoidusta happohaposta, jota puolestaan tuottaa tietyillä aineenvaihduntaprosesseilla.
 Natriumoksalaatti NA2(KUJERTAA)2 kiinteä. LEM [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons.
Natriumoksalaatti NA2(KUJERTAA)2 kiinteä. LEM [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]. Lähde: Wikimedia Commons. Sitten eräs2C2JOMPIKUMPI4 Sitä käytetään kemiallisissa analyysilaboratorioissa pelkistävänä aineena (vastakohta hapettimeen). Myös testien salliminen tietyille orgaanisille yhdisteille jäteveden hoidon aikana.
Sitä on käytetty klorofluorihiilijätteen (CGC) poistamiseen, mikä vahingoittaa otsonikerroksia. Se on myös raaka -aine oksaalihapon saamiseksi taloudellisella tavalla.
Joidenkin syötävien vihannesten korkean natriumoksalaattipitoisuuden vuoksi ihmisten, joilla on taipumus muodostaa laskelmia tai munuaiskiviä. Tämä johtuu siitä, että kivet muodostetaan yleensä oksalaateilla.
[TOC]
Rakenne
Natriumoksalaatti koostuu kahdesta natrium -katiosta+ ja oksalaattianioni (COO)22-. Oksalaattianioni muodostuu vuorostaan kahdella COO: lla- liittyi kahden hiiliatomin läpi: -Ooc-coo-.
Kiinteässä natriumoksalaatissa oksalaattianionilla on tasainen muoto. Tämä tarkoittaa, että sekä hiilit että happi löytyvät samasta tasosta.
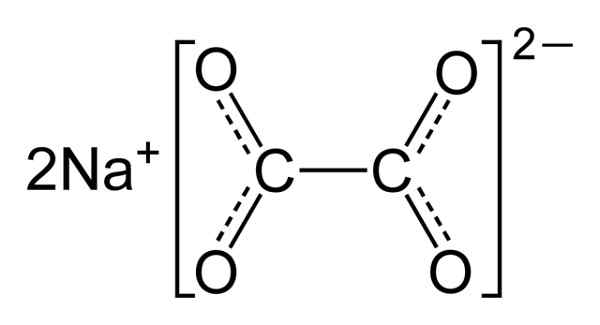 Natriumoksalaatin kemiallinen rakenne2(KUJERTAA)2. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons.
Natriumoksalaatin kemiallinen rakenne2(KUJERTAA)2. Kirjoittaja: Benjah-BMM27. Lähde: Wikimedia Commons. Nimikkeistö
- Natriumoksalaatti
- Dysodio -oksalaatti
- Natriumsuola etanodioiinihaposta
Ominaisuudet
Fyysinen tila
Kiteinen valkoinen kiinteä aine.
Molekyylipaino
134,0 g/mol
Tiheys
2,27 g/cm3 20 ° C: ssa.
Liukoisuus
Vesiliukoinen: 3,7 g/100 ml 20 ° C: ssa.
PHE
Sen vesipitoiset liuokset ovat emäksiä (emäksinen), koska oksalaatti -anionilla on taipumus ottaa vesiprotoneja jättäen ionit-.
Voi palvella sinua: Neon: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetKemialliset ominaisuudet
Se voi neutraloida hapot ja reaktiot ovat eksotermisiä, ts. Ne antavat lämpöä.
Se toimii pelkistävänä aineena ja näissä reaktioissa se tuottaa hiilidioksidia2.
Sillä on ominaisuus liittyä useisiin metalli -ioneihin, kuten rautarauta -ioneihin2+ ja rauta3+.
Saada
Kuultu lähteen mukaan natriumoksalaattia voidaan saada hapettua happea tai2 Noin 250 ° C lämpötilassa NaOH -natriumhydroksidin konsentroituneessa liuoksessa.
Läsnäolo luonnossa
Natriumoksalaattia on läsnä monissa kasveissa ja vihanneksissa, kuten chard, pinaatti ja rubarbo, ja jyvissä, kuten soijapavut, monien muiden kasvituotteiden joukossa.
 Pinaatissa on paljon natriumoksalaattia. Kirjoittaja: Aline Ponce. Lähde: Pixabay.
Pinaatissa on paljon natriumoksalaattia. Kirjoittaja: Aline Ponce. Lähde: Pixabay. Sen konjugoitu happooksaalihappo esiintyy ihmisen organismissa glykolihapon tai askorbiinihapon aineenvaihdunnalla. Kun se on tuotettu, sitä ei metaboloitu, mutta se erittyy oksalaatin muotoisella virtsalla.
 Ruibarbo sisältää natriumoksalaattia. Kirjailijat: S. Hermann & F. Rikkaus. Lähde: Pixabay.
Ruibarbo sisältää natriumoksalaattia. Kirjailijat: S. Hermann & F. Rikkaus. Lähde: Pixabay. Sovellukset
Kemiallisessa analyysilaboratoriossa
Sitä käytetään kemiallisena reagenssina, yleensä pelkistävänä aineena, esimerkiksi kaliumpermanganaattiratkaisujen standardoinnissa, ts.
Kloorofluorihiilivetyjen tuhoamisessa
Natriumoksalaattia on käytetty klorofluorihiiliveden (CFC) tuhoamiseen. Nämä CFC -yhdisteet ovat olleet yksi niistä, jotka ovat vastuussa planeetan otsonikerroksen tuhoamisesta (joka suojaa meitä ultraviolettisäteilystä).
Vuonna 1996 jotkut tutkijat ehdottivat natriumoksalaatin käyttöä niiden poistamiseksi, koska se reagoi helposti CFC: n kanssa lämpötiloissa 270-290 ° C, mikä tekee niistä vaarattomia tuotteita otsonikerrokseen.
Natriumoksalaattireaktio CFC: ien kanssa voidaan hallita halogenoitujen aromaattisten hiilivetyjen saamiseksi, jotka eivät ole haitallisia otsonikerrokselle, mutta ovat hyödyllisiä yhdisteitä kemianteollisuudessa.
Se voi palvella sinua: propeeniglykolin: rakenne, ominaisuudet, synteesi ja käyttöTämä reaktio voidaan myös tuoda maksimiin ja muuntaa koko CFC NAF -natriumfluoridiksi, SOLL -natriumkloridiksi, elementtihiili- ja hiilidioksidiyhtiöksi2.
 Planeetan otsonikerros suojaa meitä auringon ultraviolettisäteiltä. Natriumoksalaatti antaa sinun eliminoida CFC -yhdisteet, jotka vahingoittavat sitä. Kirjoittaja: One94. Lähde: Pixabay.
Planeetan otsonikerros suojaa meitä auringon ultraviolettisäteiltä. Natriumoksalaatti antaa sinun eliminoida CFC -yhdisteet, jotka vahingoittavat sitä. Kirjoittaja: One94. Lähde: Pixabay. Määritettäessä tärkeitä parametreja jäteveden hoidossa
On havaittu, että natriumoksalaatti on hyödyllinen orgaanisten yhdisteiden määrän ja luokkien mittaamiseksi, jotka erittävät jäteveden hoidossa käytettyjä lietteen mikro -organismeja.
Tällaisten yhdisteiden mitta on tärkeä niiden toiminnan määrittämiseksi jäteveden käsittelyn aikana, koska mudan erottaminen vedestä riippuu niistä.
Natriumoksalaattia käyttämällä vältetään muiden menetelmien haitat.
Oksaalihapon saamiseksi
Tiettyjen prosessien jätteiden raa'an natriumoksalaattia on käytetty oksaalihapon H tuottamiseen2C2JOMPIKUMPI4 suuria määriä.
Menetelmä käyttää lietteitä Bayer -prosessista bauksiitin (alumiinin mineraali) hoitamiseen. Bayer -prosessissa bauksiittia käsitellään NaOH -natriumhydroksidilla tämän mineraalin alumiinioksidin liuottamiseksi.
Alumiinioksidin liuentamisprosessissa tietyt mineraalissa esiintyvät orgaaniset yhdisteet hyökkäävät NaOH: lla, mikä tuottaa suuren määrän natriumoksalaattia na2C2JOMPIKUMPI4.
Tämä natriumoksalaatti on sisällytetty mutaan alumiiniyhdisteiden kanssa. Sen puhdistamiseksi kokoonpano on liuennut, se suodatetaan ja johdetaan happaman tyyppisen ioninvaihtopylvään läpi.
Pylväässä on RSO -sulfonihappohartsi3H, missä Na -metalli -ionit vaihdetaan+ vety -ioneilla H+, Joten saat oksaalihapon H2C2JOMPIKUMPI4.
RSO3H + NA2C2JOMPIKUMPI4 Rso3Na + NAHC2JOMPIKUMPI4
Voi palvella sinua: kaliumkarbonaatti (K2CO3): rakenne, ominaisuudet, käyttötarkoitukset, hankkiminenRSO3H + NAHC2JOMPIKUMPI4 Rso3Na + H2C2JOMPIKUMPI4
Tämä on taloudellinen prosessi ja saatu oksaalihappo on hyväksyttävä puhtaus.
Ei -toivottujen yhdisteiden poistaminen
Konjugoitu natriumoksalaattihappo, oksaalihappo H2C2JOMPIKUMPI4, Sitä käytetään tietyntyyppisten jätteiden ja sisääntulojen liuottamiseen.
Oksalaattiin tulemisen oksaalihappoa käytetään toimimaan kompleksina tai saostavana aineena esimerkiksi erilaisten ydinpolttoaineiden jätteiden käsittelyn aikana.
Oksaalihappoa käytetään myös putkien ja muiden laitteiden mineraalien ja rautaoksidien ulottuvuuksien poistamiseen, tämä johtuu sen kyvystä liittyä voimakkaasti rauta -ionin uskoon2+ rauta -ionin usko3+ muodostaa oksalaatteja.
Riskejä
Jos natriumoksalaattia hengitetään tai nielee suoraan. Se tuottaa oksentelua, vaikeaa puhdistusta, heikkoa pulssia, sydän- ja verisuonitautoa, hermosolujen oireita ja munuaisvaurioita.
Ihmisten, joilla on taipumus muodostaa laskelmia munuaisissa oksalaatin kertymisen vuoksi virtsaan, tulisi välttää vihannesten kuluttamista, joilla on korkea liukoinen oksalaatti, kuten natrium.
Natriumoksalaatti suurissa määrissä elintarvikkeissa, kun virtsaa saavutetaan tässä läsnä olevaan kalsiumiin ja voi tuottaa munuaisten kalsiumoksalaatin laskelmia tai kiviä ihmisille, joilla on taipumus tehdä niin.
 Joidenkin ruokien natriumoksalaatti voi johtaa kivien muodostumiseen ihmisten munuaisissa, joilla on taipumus siihen. Kirjoittaja: Azwer. Lähde: Pixabay.
Joidenkin ruokien natriumoksalaatti voi johtaa kivien muodostumiseen ihmisten munuaisissa, joilla on taipumus siihen. Kirjoittaja: Azwer. Lähde: Pixabay. Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Natriumoksalaatti. Kansallinen bioteknologiatietojen keskus. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Chai, w. Ja Liebman, M. (2005). Eri keittomenetelmien vaikutus vihannesoksalaattipitoisuuteen. J -. Maatalous-. Elintarvikekemia. 2005, 53, 3027-3030. Pubista toipunut.ACS.org.
- Dagani, r. (1996). CFC tuhoaa reionia. Chemical & Engineering News Archive 1996, 74, 4, 6-7. Pubista toipunut.ACS.org.
- Sajad, m. ja Kim, k.S. (2016). Solunulkoisten polymeeristen aineiden uutto aktivoidusta lietteestä natriumoksalaattia käyttämällä. Int. J -. Ympäristö. Sci. Tekniikka. 13, 1697-1706 (2016). Linkki palautettu.Jousto.com.
- Jeffrey, G.-Lla. Ja parry, g.S. (1954). Natriumoksalaatin kiderakenne. J -. OLEN. Kemia. Soc. 1954, 76, 21, 5283-5286. Pubista toipunut.ACS.org.
- Okuwaki, a. et al. (1984). Oksalaatin tuotanto hiilen hapettamalla happea samanaikaisessa natriumhydroksidiliuoksessa. Ind. Eng. Kemia. Antaa. Naudanliha. Kehitys. 1984, 23, 648-651. Pubista toipunut.ACS.org.
- Hefter, G. et al. (2018). Natriumoksalaatin liukoisuus konsentroituneissa elektrolyyttiliuoksissa. J Chem & Eng -tiedot. 2018, 63, 3, 542-552. Pubista toipunut.ACS.org.
- Lau. Yllyttää. (1992). Prosessi oksaalihapon ja natriumvetyoksalaatin valmistamiseksi raa'asta natriumoksalaatista. TAI.S. Patentti nro 5,171 887. Joulukuu.15, 1992. Haettu FreePatentssonline.com.
- « Haptes -historia, toiminnot, ominaisuudet, immunes vastaukset
- Natrium -kolmifosfaatti (NA5P3O10) rakenne, ominaisuudet, käytöt, isku »

