Oksácido

- 4599
- 1190
- Edgar VonRueden
 Perektaleetikkohapon molekyyli, erittäin harvinainen Tecnecion happea. Lähde: Jynto, Wikimedia Commons
Perektaleetikkohapon molekyyli, erittäin harvinainen Tecnecion happea. Lähde: Jynto, Wikimedia Commons Mikä on oksasidi?
Eräs oksácido, U oksoacid, se on happo, joka sisältää happea. Se koostuu vedystä, hapesta ja ei -metallisesta elementistä, joka muodostaa niin kutsutun keskusatomin. Happiatomien lukumäärästä riippuen, ja siksi ei -metallisesta elementin hapetustilat voivat muodostaa useita oksasideja.
Oxcasidilla on suuri määrä käyttötarkoituksia, joita on vaikea kuvailla yleensä. Sen sovellus riippuu suuresti keskusatomista ja hapen lukumäärästä.
Ne voivat palvella yhdisteistä materiaalien, lannoitteiden ja räjähteiden synteesiä varten3Poikki4, olla osa näiden juomien koostumusta.
Oksimahasten ominaisuudet ja ominaisuudet
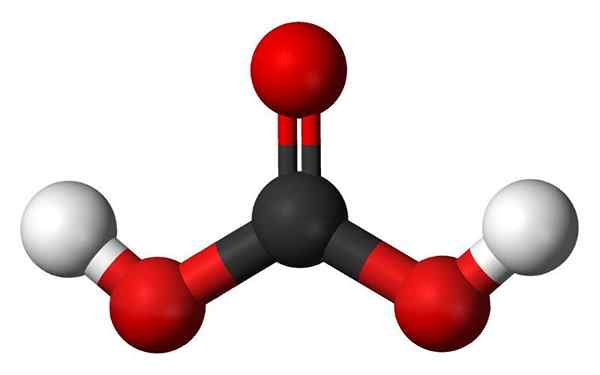 Hiilihappomolekyyli. Lähde: Jynto ja Ben Mills, Wikimedia Commons
Hiilihappomolekyyli. Lähde: Jynto ja Ben Mills, Wikimedia Commons - Hydroksyyliryhmät: Yksi Oxácidon pääpiirteistä ei ole vain se, että sillä on happea, vaan myös tämä on kuin OH -ryhmä. Toisaalta joillakin oksasideilla on niin kutsuttu oksoryhmä, e = o. Fosforihapon tapauksessa siinä on OxO -ryhmä, p = o. Heillä ei ole H -atomeja, joten "he eivät ole vastuussa" happamuudesta.
- Keskeinen atomi: Keski -atomi (E) voi olla tai ei ole elektronegatiivinen elementti riippuen sen sijainnista jaksollisen taulukon lohkossa P. Toisaalta happi, hieman enemmän elektronegatiivista elementtiä kuin typpi, houkuttelee OH -sidoksen elektroneja, mikä mahdollistaa ionin H vapautumisen+. E on siksi sidoksissa OH -ryhmiin. Kun ioni H vapautetaan+ Happoionisaatio tapahtuu, toisin sanoen se saa sähkövarauksen, joka sen tapauksessa on negatiivinen. OxcAcid voi vapauttaa niin monta H -ionia+ Kuten OH -ryhmät ovat rakenteessaan, ja mitä enemmän niitä on, sitä suurempi negatiivinen kuorma on.
- Hapan voima: Lähes kaikkien oksasidien voima, jolla on sama keskusatomi (ei metallia), kasvaa keskuselementin hapettumistilan lisääntyessä, mikä puolestaan liittyy suoraan happiatomien lukumäärän kasvuun.
Esimerkiksi esitetään kolme oksasidisarjaa, joiden happamuusvoimat järjestetään vähiten suurimmaksi:
H2Sw3 < H2Sw4
Hno2 < HNO3
Hclo < HClO2 < HClO3 < HClO4
Useimmissa oksasideissa, joilla on erilaisia elementtejä, joilla on sama hapettumistila, mutta jotka kuuluvat samaan jaksollisen taulukon ryhmään, happamuusvoima kasvaa suoraan keskusatomin elektronegatiivisuuden kanssa:
H2SEO3 < H2Sw3
H3Poikki4 < HNO3
Hehku4 < HClO4
Oksanmuodostumat
Kuten alussa mainittiin, oksácidot syntyy, kun tietyt aineet, joita kutsutaan happioksideiksi, reagoivat veden kanssa. Tämä selitetään käyttämällä samaa esimerkkiä hiilihapposta.
Co₂+h₂o h2Yhteistyö3
Happioksidi + vesi => oxácido
Mitä tapahtuu, on, että H₂on molekyyli sitoutuu kovalenttisesti co₂: n kanssa. Jos vesi eliminoidaan lämmöllä, tasapaino siirtymien uudistamiseen, ts. Kuuma soodajuoma menettää pian poreilevan tunteensa kuin kylmä.
Toisaalta happosoksidit muodostuvat, kun ei -metallinen elementti reagoi veden kanssa, vaikka tarkemmin sanottuna, kun reagoiva elementti muodostaa oksidin, jolla+.
On jo sanottu, että ionit h+ Ne ovat tuloksena olevan oksasidi -ionisaation tuote.
Koulutusesimerkit
Kloorioksidi, Cl2JOMPIKUMPI5, Reagoi veden kanssa kloorihapon antamiseksi:
Cl2JOMPIKUMPI5 + H₂o => hclo3
Rikkioksidi, niin3, Reagoi veden kanssa rikkihapon muodostamiseksi:
Sw3 + H₂o => h2Sw4
Ja periódic oksidi, i2JOMPIKUMPI7, Reagoi veden kanssa periódiinihapon muodostamiseksi:
Yllyttää2JOMPIKUMPI7 + H₂o => hio4
Näiden klassisten oksasidien muodostumisen mekanismien lisäksi on myös muita reaktioita samaan tarkoitukseen.
Voi palvella sinua: endoterminen reaktioEsimerkiksi fosforitrikloridi, PCL3, Se reagoi veden kanssa fosforihapon, oksácidon ja suolahapon, halohydric -hapon tuottamiseksi.
PCL3 + 3H2O => h3Poikki3 + HCL
Ja fosfori -pentakloridi, PCL5, Reagoi veden kanssa fosforihapon ja suolahapon saamiseksi.
PCL5 + 4 h₂o => h3Poikki4 + HCL
Metallioksidit
Jotkut siirtymämetallit muodostavat happioksidejä, ts. Ne liukenevat veteen oksasidien antamiseksi.
Mangaanioksidi (VII) (permanganinen anhydrum) mn2JOMPIKUMPI7 Ja kromioksidi (VI) ovat yleisimmät esimerkit.
Mn2JOMPIKUMPI7 + H₂o => hmno4 (permanganiinihappo)
Kro3 + H₂o => h2Kro4 (kromihappo)
Nimikkeistö
Valencia -laskenta
Oxácidin oikein nimittäminen. Alkaen HEO: n geneerisestä kaavasta seuraavaa otetaan huomioon:
- O: lla on Valencia -2.
- Valencia de los h es +1.
Tätä silmällä pitäen oxácid. Siksi sinulla on seuraava algebrallinen summa:
-2 + 1 + E = 0
E = 1
Siksi E on +1 valencia.
Sitten mahdolliset valenssit, joilla voi olla ja. Jos niiden valenssien joukossa ovat arvoja +1, +3 ja +4 ja sitten "työskentele" sen alaikäisen Valencian kanssa.
Nimetä happo
Heon nimittäminen alkaa kutsumalla sitä happona, jota seuraa E -nimi jälkiliitteillä -CO, jos työskentelet suurimman Valencian tai -onon kanssa, jos työskentelet alaikäisen kanssa. Kun niitä on kolme tai enemmän, hypo-etuliitteitä käytetään viittaamaan pieniin ja suurempiin valensseihin.
Siten Heoa kutsutaan:
Hapan hikka(E: n nimi)karhu
Koska +1 on pienintäkään sen kolmesta valenssista. Ja jos se olisi Heo2, Sitten minulla olisi Valencia +3 ja sitä kutsutaan:
Se voi palvella sinua: difenyyliamiiniHappo (e)karhu
Ja samalla tavalla Heolle3, Kun E työskentelee Valencia +5: n kanssa:
Happo (e)ICO
Esimerkit
- Kromihappo (H2Cr2JOMPIKUMPI4-A. Se on vahva, epävakaa happo korkeissa lämpötiloissa.
- Dikromihappo (H2Cr2JOMPIKUMPI7-A. Sen läsnäolo on havaittavissa kromihapposeoksissa, joita käytetään lasin puhdistamiseen.
- Hypokloorihappo (HCLO). Korjaa nopeasti ihokudokset.
- Bromihappo (hbro2-A. Se on välituote, epävakaa yhdiste. Bromiyhdiste.
- Ortofosforihappo (H3Poikki4-A. Ärsyttävä happo ei -polttoaineen iholle.
- Permanganiinihappo (HMNO4-A. Erittäin vahva happo.
- Periódiinihappo (HIO4-A. Orgaanisessa kemiassa sitä käytetään muiden molekyylien rakenteiden analysointiin.
- Bromihappo (hbro3-A. Bromin härkä. Hänen suolansa hapetaan voimakkaasti.
- Hypobrominen happo (HBRO). Sitä käytetään laimennetussa vesiliuoksessa ja saadaan reaktiolla veden ja BR: n välillä2.
- Metafosforihappo (HPO3-A. Erittäin syövyttävä, väritön ja wc kiinteä huoneenlämpötilassa.
- Yodiumihappo (HIO3-A. Reaktiivinen, jota käytetään morfiinin havaitsemiseksi tuotteessa.
- Rikkihappo (H2Sw3-A. Aiheuttaen happaa.
- Rikkihappo (H2Sw4-A. Säännöllinen metallinprosessointiin ja lannoitteisiin, se on yksi eniten käytetyistä kemiallisista yhdisteistä.
- Typpihappo (HNO3-A. Laboratorioreagenssi, erittäin vaarallinen, koska se voi polttaa ihoa.
- Kloorihappo (HCLO3-A. Hajottaessa se tuottaa paljon tuotteita. Se on kylmä vakaa 30%: n pitoisuuteen.
- Arseniosohappo (H3ASO3-A. Sisältää arseenia ja on erittäin myrkyllinen ja syöpää. Sitä käytetään rikkakasvien torjunta -aineet ja torjunta -aineet.
- Ortosiiliinihappo (H4Sitoa4-A. Heikko happo, jota käytetään tuki- tai kuivausaineena.
- Hiilihappo (H2Yhteistyö3-A. Sitä käytetään virvoitusjuomien valmistukseen.
- Typpihappo (HNO2-A. Liuoksessa se on huomattavan dissosioitunut.
- Metaborihappo (HBO2-A. Kevyesti liukoinen kiteinen valkoinen kiinteä kiinteä kiinteä kiinteä.
Viitteet
- Yleiset oksoasidiyhdisteet. Toipunut Ajatelukyvystä.com.

