Oksihemoglobiinin ominaisuudet, rakenne ja risteyskäyrä
- 4613
- 176
- Edgar VonRueden
JOMPIKUMPIXihemoglobin Se on nimi, jonka hemoglobiini vastaanottaa, kun se liittyy happea. Hemoglobiini on proteiini, joka on punasolujen sisällä ja jonka päätehtävänä on kuljettaa happea keuhkoista kudoksiin.
Ensimmäiset elävät olennot olivat yksisoluisia ja asuivat nestemäisessä ilmakehässä, josta niitä ravittiin ja johon ne eliminoivat jätteensä, samoin kuin jotkut nykyisistä organismeista. Näissä olosuhteissa nämä prosessit saavutetaan yksinkertaisilla leviämismekanismeilla, koska soluseinä on läheisessä yhteydessä väliaineen kanssa, joka toimittaa sitä.
 Oxihemoglobiinin dissosiaatiokäyrä (lähde: Ratznium englanniksi Wikipedialat -versioissa aaronsharpe latasi.Wikipedia. [Julkinen alue] Wikimedia Commonsin kautta)
Oxihemoglobiinin dissosiaatiokäyrä (lähde: Ratznium englanniksi Wikipedialat -versioissa aaronsharpe latasi.Wikipedia. [Julkinen alue] Wikimedia Commonsin kautta) Yhä monimutkaisempien plurisellulaaristen organismien kehitys tarkoitti, että sisäiset solut siirrettiin huomattavasti pois ympäristöstä, joten leviämismekanismit, kun ainoa tarjontalähde tuli riittämättömäksi.
Siten kehitettiin erikoistuneita järjestelmiä ravintoaineiden ja kaasujen, kuten ruuansulatusjärjestelmän ja hengityselinten, sekä kuljetusmekanismien saamiseksi näiden ravintoaineiden ja kaasujen tuottamiseksi soluun: sydän- ja verisuonijärjestelmä.
Energian tuottamiseksi ATP -molekyylien muodossa solut tarvitsevat happea. Ottaen huomioon, että ATP: tä ei voida tallentaa, sitä on syntetisoitava jatkuvasti, mikä tarkoittaa solujen pysyvää happea kysyntää.
Hemoglobiini syntyi evoluutiossa sanottuna kaasunkuljettajana, joka "ratkaisee" hapenkuljetuksen ongelman ympäristöstä soluun.
[TOC]
Ominaisuudet ja rakenne
Oksihemoglobiinin ominaisuuksista ja rakenteesta puhuminen on tarpeen viitata hemoglobiiniin, koska oksihemoglobiini ei ole muuta kuin happea hemoglobiini. Siksi kuvataan tästä lähtien molekyylin nivelominaisuudet tai ei kyseessä olevasta kaasusta.
Mikä on hemoglobiini?
Hemoglobiini on välttämätöntä hapen kuljettamiseksi kudoksiin määrän ja nopeuden, jota he ansaitsevat, koska happea on niin vähän veren liukoisuutta, että sen diffuusiokuljetus olisi riittämätöntä kudostarpeiden toimittamiseen.
Voi palvella sinua: todisteet elävien olentojen kehityksestäKuinka hemoglobiinimolekyyli on?
Hemoglobiini on tetrameerinen proteiini (jolla on neljä alayksikköä), pallomainen muoto ja molekyylimassa on 64 kDa.
Sen neljä alayksikköä muodostavat yhden funktionaalisen yksikön, jossa kukin vaikuttaa vastavuoroisesti toiseen. Jokainen alayksikkö koostuu polypeptidiketjusta, globiinista ja proteesiryhmästä, hemo- tai "HEM" -ryhmästä, joka toimii kofaktorina ja jota ei ole muodostettu aminohappojen avulla; eli se ei ole proteiinin luonne.
Globin on kahdella tavalla: Alpha Globin ja Beta Globin. Hemoglobiini -tetrameeri koostuu parista alfa -globiiniketjuista (141 aminohappoa) ja parista beeta -globiiniketjuista (146 aminohappoa).
Jokainen neljästä polypeptidiketjusta on kytketty HEMO -ryhmään, jolla on rautatomi rautatiloissa (Fe2+) keskellä.
Kuinka Hemo -ryhmä on?
HEMO -ryhmä on porfyriinirengas, joka muodostuu neljällä pyrrolisella renkaalla (heterosykliset aromaattiset yhdisteet kaavan C4H5N: n kanssa), jotka yhdistyvät metyylisilloilla. Keskustaan löydetty rauta rauta on rakenne koordinoiduilla typpilinkillä.
Jokainen HEMO -ryhmä pystyy liittymään happimolekyyliin, joten jokainen hemoglobiinimolekyyli voi liittyä vain 4 kaasumolekyyliä.
Ihmiskeho sisältää noin 2,5 x 1013 punasoluja, jotka ovat verisoluja, jotka tuottavat ja kuljettavat hemoglobiinia. Jokaisessa punasoluissa on noin 280 miljoonaa hemoglobiinimolekyyliä, ja se voi sitten kuljettaa yli 1000 miljoonaa happimolekyyliä.
Voi palvella sinua: hominisointiprosessi: Ominaisuudet ja vaiheetKuinka oksihemoglobiini muodostetaan?
Oxihemoglobiini muodostuu happiatomin liiton jälkeen jokaiselle rauta -atomille, joka löytyy hemoglobiinimolekyylin jokaisesta hemo -ryhmästä.
Termi oksihemoglobiini viittaa sitten hapetettuun eikä kemiallisesti hapettuneen hemoglobiiniin, koska se ei menetä elektronia yhdistettynä happea ja rautaa jää rautatilaan.
Hapetus tuottaa muutoksen molekyylin kvaternäärisessä rakenteessa, toisin sanoen konformaation muutoksen, joka voidaan siirtää globiiniketjuista hemoon ja päinvastoin.
Mikä on hapen enimmäismäärä, joka voi ladata hemoglobiinia?
Hemoglobiini voi korkeintaan liittyä neljään happimolekyyliin rakenteeseensa. Jos ihanteellisten kaasujen molaarinen tilavuus on 22.4 l/mol, yksi mol hemoglobiinia (64.500G) liittyy 89: llä.6 litraa happea (4 moolia O2 x 22.4 l/mol).
Joten jokaisen hemoglobiinin gramman on liityttävä 1.39 ml O2 on 100% tyydyttynyt (89.6L/64500G x (1000 ml/l)).
Käytännössä verikokeet osoittavat hiukan alhaisempia tuloksia, koska methemoglobiinia (hapettunut hemoglobiini) ja karboksihemoglobiinia (hemoglobiini + hiilimonoksidia (CO)) on pieniä määriä, jotka eivät voi liittyä happea.
Kun otetaan huomioon tämä, Hüfner -sääntö osoittaa, että veressä 1 g hemoglobiinia on maksimaalinen kyky yhdistää happi 1.34ml.
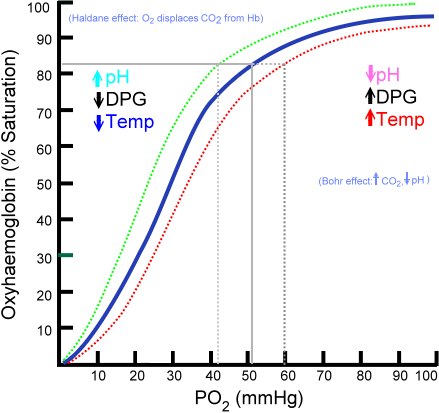
Oksihemoglobiinin sitoutumiskäyrä
Hamoglobiinimolekyyliin yhdistävien happimolekyylien määrä riippuu osittaisesta happipaineesta tai PO2: sta. Hapen puuttuessa hemoglobiini dekoituu, mutta PO2 kasvaa, hemoglobiiniin sitoutuneen hapen lukumäärä kasvaa.
Hapen sitoutumisprosessi hemoglobiiniin riippuen osittaisesta happipaineesta. Naistuessa tulosta kutsutaan "oksihemoglobiinikäyräksi", ja sillä on ominainen muoto 'S' tai Sigmoid.
Voi palvella sinua: TaxismPO2: sta riippuen hemoglobiini on vähemmän tai suurempi kyky "vapauttaa" tai "toimittaa" sen kuljettamaa happea sekä latautua tähän.
Esimerkiksi alueella 10 - 60 mmHg painetta saat osan enemmän odottaen käyrää odottaen. Tässä tilassa hemoglobiini voi helposti tuottaa suuria määriä O2: ta. Tämä on tila, joka saavutetaan kudoksissa.
Kun PO2 on välillä 90 - 100 mmHg (12 - 13 kPa), hemoglobiini on melkein 100% kyllästetty O2: lla; Ja kun valtimo PO2 on 60 mmHg (8 kPa), kylläisyys O2: lla on edelleen jopa 90%.
Keuhkoissa nämä ovat olosuhteet, jotka ovat vallitsevia (paine välillä 60 - 100 mmHg), ja tämä mahdollistaa hemoglobiinimolekyylit, jotka ovat läsnä erytrosyyteissä ladata happea.
Tämä sigmoidimuoto, joka vetää oksihemoglobiinikäyrän vaatia.
Viitteet
- Kettu, s. Yllyttää. (2006). Ihmisen fysiologia 9. painos (PP. 501-502). McGraw-Hill Press, New York, USA.
- Murray, r. K -k -., Granner, D. K -k -., Mayes, P. -Lla., & Rodwell, V. W -. (2014). Harperin kuvitettu biokemia. McGraw-Hill.
- Rawn, j. D -d. (1998). Biokemia (1989). Burlington, Pohjois -Carolina: Neil Patterson Publishers (C) N. Lalioti, cp raptopoulou, a. Terzis, a. Panagiotopoulos, sp perlepes ja. Manessi-zoupa, J. Kemia. Soc. Dalton Trans, 1327.
- Robert M. Berne, Matthew N. Perimä. (2001) Fysiologia. (3. painos.) Harcourt Editions, S.-Lla.
- West, J. B -. (1991). Lääketieteellisen käytännön fysiologinen perusta. Williams & Wilkins
- « Erytropoietiini (EPO) ominaisuudet, tuotanto, toiminnot
- Dystrofiinin ominaisuudet, rakenne ja toiminnot »

