Dystrofiinin ominaisuudet, rakenne ja toiminnot
- 1134
- 143
- Mr. Clifford Kshlerin
Se dystrofiini Se on proteiini, joka muodostaa sokeriruo'on tai sauvan muodossa, joka liittyy luurankojen, sileiden ja sydämen lihassolujen kalvoon, esiintyy myös hermosoluja ja muissa ihmiskehon elimissä.
Sillä on samanlaisia kuin muiden sytoskeletonproteiinien toiminnot, ja uskotaan, että se toimii pääasiassa lihaskuitukalvon stabiilisuudessa ja solunulkoisen peruskalvon liitossa solunsisäisen sytoskeleton kanssa.
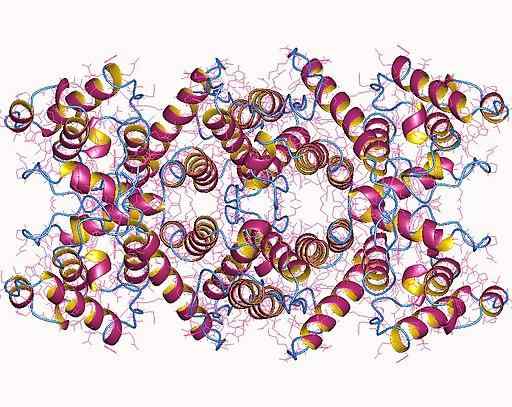
 Dystrofiinin molekyylirakenne (lähde: Norwood, F.Lens., Sutherland-Smith, a.J -., N.H., Kendrick-Jones, J.; Visualisointi Tekijä: Käyttäjä: Astrojan [CC BY-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Dystrofiinin molekyylirakenne (lähde: Norwood, F.Lens., Sutherland-Smith, a.J -., N.H., Kendrick-Jones, J.; Visualisointi Tekijä: Käyttäjä: Astrojan [CC BY-Sa 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Se on koodattu X -kromosomiin, yhdessä suurimmista ihmisille kuvattuista geeneistä, joiden mutaatiot osallistuvat sukupuolikromosomeihin liittyviin patologioihin, kuten Duchennen lihasdystrofia (DMD) (DMD) (DMD) (DMD) (DMD) (DMD) (DMD).
Tämä patologia on toiseksi yleisin perinnöllinen häiriö maailmassa. Se vaikuttaa yhteen jokaisesta 3500 miehestä, ja se käy ilmi 3–5 vuotta kiihtyneenä lihasten kulumisena, joka voi vähentää elämäaikaa enintään 20 vuoteen.
Dystrofiinigeeni eristettiin ensimmäisen kerran vuonna 1986, ja se karakterisoitiin käyttämällä paikallista kloonausta, mikä tarkoitti suurta edistystä ajan molekyylin genetiikkaan.
[TOC]
Ominaisuudet
Dystrofiini on hyvin monipuolinen proteiini, joka liittyy lihassolujen (sarkolema) ja muiden kehon järjestelmien solujen plasmamembraaniin.
Sen monimuotoisuus johtuu prosesseista, jotka liittyvät sitä koodaavan geenin ekspression säätelyyn, joka on yksi suurimmista ihmisille kuvattuista geeneistä. Tämä johtuu siitä, että sillä on yli 2.5 miljoonaa perusparia, jotka edustavat noin 0.1% genomista.
Tämä gen. Se koostuu noin 99% introneista, ja koodausalue on edustettuna vain 86 eksonissa.
Voi palvella sinua: Punainen fenolista: Ominaisuudet, valmistelu, sovelluksetTämän proteiinin tunnistetaan kolme erilaista isomuotoa, jotka tulevat kolmen eri promoottorin transkriptoitujen lähettiläiden translaatiosta: sellainen, jota löytyy vain kortikaalisista ja hippokampuksen neuroneista, toinen Purkinje -soluissa (myös aivoissa) ja viimeinen lihaksessa lihaksessa solut (luuranko ja sydän).
Rakenne
Koska dystrofiinigeeni voidaan "lukea" eri sisäisistä promoottoreista, tästä proteiinista on erilaisia isomuotoja, joilla on tietysti erikokoisia. Tämän perusteella alla on kuvattu "täydellisten" ja "lyhyiden" isomuotojen rakenne.
"Koko" tai "täydellinen" isoformit
Dystrofiinin "kokonaiset" isomuodot ovat sokeriruo'onmuotoisia proteiineja, joilla on neljä välttämätöntä domeenia (N-terminaalinen, keskusdomeeni, rikas domeeni kysteiineissä ja C-terminaalinen domeeni), jotka yhdessä painavat hieman yli 420 kDa ja joilla on enemmän tai vähemmän 3.685 aminohappojäte.
N-terminaalinen domeeni on samanlainen kuin a-aktiiniinin (aktiini-ammattiproteiini) ja sillä voi olla välillä 232-240 aminohappoa, isoformista riippuen. Keski- tai sokeriruo'on alue koostuu 25: stä kolminkertaisesta kierteisestä toistuvasta toistuvasta muodosta, jotka ovat samanlaisia kuin spektri ja siinä on noin 3000 aminoocid -jätettä.
Keskusdomeenin C-terminaalisella alueella, jonka muodostaa runsaasti rikas kysteiiniä, on noin 280 jätettä ja se on hyvin samanlainen kuin syyt proteiineissa, kuten kalmoduliinissa, a-aktiiniinissa ja β-p-spektriinissä. Proteiinin C-terminaalinen domeeni koostuu 420 aminohapposta.
"Lyhyt" isoformit
Koska dystrofiinigeenillä on ainakin neljä sisäistä promoottoria, voi olla proteiineja, joilla on eri pituudet, jotka eroavat toisistaan niiden domeenien puuttuessa.
Jokaisella sisäisellä promoottorilla on ainutlaatuinen entinen exone), jotka ilmaistaan kehon eri alueilla.
Voi palvella sinua: steroidihormoneja: rakenne, synteesi, toimintamekanismiDP260 ilmenee verkkokalvossa ja esiintyy rinnakkain "täydellisillä" lihas- ja aivomuotoilla. DP140 löytyy aivoista, verkkokalvosta ja munuaisista, kun taas DP116: ta löytyy vain aikuisten perifeerisistä hermoista ja DP71: stä on useimmissa ei -lihaskudoksissa.
Funktiot
Eri kirjoittajien mukaan dystrofiinilla on erilaisia toimintoja, jotka eivät vain tarkoita sen osallistumista sytoskeletonproteiinina.
Kalvojen vakaus
Dystrofiinin päätoiminta hermo- ja lihassolukalvoon liittyvänä molekyylinä on olla vuorovaikutuksessa ainakin kuuden erilaisen kattavan kalvoproteiinin kanssa, joiden kanssa se liittyy dystropiini-glukoproteiinikompleksien muodostamiseksi.
Tämän kompleksin muodostuminen tuottaa ”sillan” lihas- tai sarkolema -solukalvon läpi ja yhdistää ”joustavasti” solunulkoisen matriisin pohjalevyn sisäisen sytoskeletonin kanssa.
Dystrofiini-glukoproteiinikompleksi toimii kalvon stabiloinnissa ja lihaskuitujen suojaamisessa nekroosilta tai vaurioilta, jotka aiheuttavat indusoidun supistumisen pitkään aikaan, joka on osoitettu käänteisen genetiikan kautta.
Tätä "stabilointia" pidetään yleensä analogisena.
Signaalinsiirto
Dystrofiini tai pikemminkin proteiinikompleksi, joka muodostuu kalvon glykoproteiineista.
Sen sijainti viittaa siihen, että se voi osallistua aktiinifilamenttien jännityksen siirtymiseen lihaskuidun saromeissa plasmamembraanin läpi kohti solunulkoista matriisia, koska se liittyy fyysisesti näihin filamenteihin ja solunulkoiseen tilaan.
Se voi palvella sinua: kirkkaanvihreä agar: mikä on, perusta, valmistelu, käyttöTodisteet muista signaalinsiirron toiminnoista on irrotettu joistakin dystrofiinigeenin mutanteilla suoritetuista tutkimuksista, joissa viat havaitaan signaloinnissa vesiputouksilla, jotka liittyvät ohjelmoidun solukuoleman tai solujen puolustuksen kanssa.
Viitteet
- An, a., & Kunkel, L. (1993). Dystrofiinin rakenteellinen ja toiminnallinen monimuotoisuus. Luontogenetiikka, 3, 283-291.
- Doubek, r. W -. (1950). Korkeatuottoinen histologia (2. painos.-A. Philadelphia, Pennsylvania: Lippinott Williams & Wilkins.
- Ervarti, J., & Campbell, K. (1993). Dystrofiini ja kalvon luuranko. Nykyinen mielipide solubiologiassa, 5, 85-87.
- Hoffman, E. P., Ruskea, r. H., & Kunkel, L. M. (1987). Dystrofiini: Duchennen lihasdystrofian lokuksen proteiinituote. Solu, 51, 919-928.
- Koenig, m., Monaco, a., & Kunkel, L. (1988). Dystrofiiniproteiinin täydellinen sekvenssi sauvamuotoinen sytoskeletaalinen sytoskeletaalinen sytoskeleti. Solu, 53, 219-228.
- Lukea., Söimi, s. J -., & Hubert, J. (2010). Biochimica et Biophysica Acta -dystrofiini: enemmän kuin vain sen osien summa. Biochimica et Biophysica Acta, 1804(9), 1713-1722.
- Rakkaus, D., Byth, b., Tensley, J., Blake, D., & Davies, K. (1993). Dystrofiini- ja dystrofiiniin liittyvät proteiinit: Katsaus proteiini- ja RNA-tutkimuksiin. Neuromusku. Häiriö., 3(1), 5-21.
- Muntoni, f., Torelli, S., & Ferlini,. (2003). Dystrofiini ja mutaatiot: yksi geeni, useita proteiineja, useita fenotyyppejä. Lancet -neurologia, 2, 731-740.
- Pasternak, c., Wong, s., & Elson, E. Lens. (tuhatyhdeksänsataayhdeksänkymmentäviisi). Dystrofiinin mekaaninen toiminta lihassoluissa. Journal of Cell Biology, 128(3), 355-361.
- Sadoulet-Puccio, H. M., & Kunkell, L. M. (1996). Dystrofiini ja sen LSOFORMS. Aivopatologia, 6, 25-35.
- « Oksihemoglobiinin ominaisuudet, rakenne ja risteyskäyrä
- Tropomiosiinin ominaisuudet, rakenne ja toiminnot »

