Vetyperoksidirakenne (H2O2), ominaisuudet, käyttää, saada

- 1981
- 202
- Joshua Emmerich
Hän vetyperoksidi Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on H2JOMPIKUMPI2. Kaikki ovat tämän kemiallisten yhdisteiden perheen yksinkertaisin peroksidi. Sen rakenteellinen kaava on H-O-O-H-H, tämä sisäinen hapetettu silta on ominainen kaikille peroksideille.
Vuonna 1818, h2JOMPIKUMPI2 Sen tunnisti Louies Jacques Thénard, joka valmisti kemiallisen yhdisteen, jonka hän vaati silloista Huzigenada. Se on epävakaa yhdiste, hajoaa altistumalla valolle, lämmölle ja joillekin metalleille.
 Vetyperoksidin kemiallinen kaava
Vetyperoksidin kemiallinen kaava Se on erittäin hyödyllinen yhdiste, jota käytetään pienten haavojen desinfioinnissa, hiusten valkaisussa, vedenkäsittelyssä jne. Vaikka hänellä voi olla haitallisia toimia ihmiselle, sitä löytyy kaikista elävien olentojen eukaryoottisoluista, joissa hän suorittaa useita hyödyllisiä toimintoja.
Vetyperoksidi tuottaa myrkyllisten aineiden, kuten fenolien, etanolin, formaldehydin, jne., Maksan ja munuaiset eliminoivat tuotteet. Lisäksi se myötävaikuttaa neutrofiilien ja makrofagien leukosyyttien fagosyoitujen bakteerien tuhoamiseen.
[TOC]
Rakenne
Molekyyli
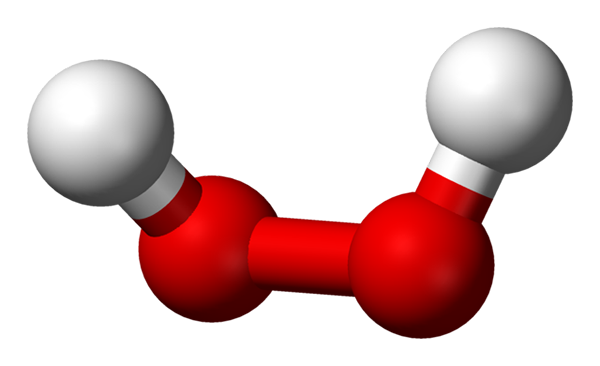 Vetyperoksidimolekyyli, jota esitetään palloilla ja baarimallilla. Lähde: Benjah-BMM27 Wikipedian kautta.
Vetyperoksidimolekyyli, jota esitetään palloilla ja baarimallilla. Lähde: Benjah-BMM27 Wikipedian kautta. Ylemmässä kuvassa H -molekyylin rakenne voidaan nähdä2JOMPIKUMPI2 (H-O-O-H), punaisilla palloilla, jotka vastaavat happiatomeja ja valkoisia vetyatomeja. Huomaa, että molekyyli ei ole tasainen ja että atomit h kumpikaan ei ole varjostettu avaruuteen (yksi toisen edessä).
Mielenkiintoista, että h2JOMPIKUMPI2 Sen yksinkertaisen keskeisen linkin O-O: n kiertäminen on vaikeaa, joten näiden H: n sijaintia ei voida vaihtaa; Yksi ei mene alas, kun toinen nousee.
Koska? Koska kahdessa happiatomissa on kaksi elektronittomia paria, mikä antaa yhteensä kahdeksan hyvin läheistä elektronia ja joka hylkää toisiaan negatiivisten varaustensa vuoksi.
Kierto
Silti O-O.
Esimerkiksi, kun yhdessä kahden peukalon kanssa, sormet ojenneivat ja muut suljettiin, kuten tuomioistuimen piirtäminen ja sitten peukalon kääntäminen siten, että yksi sormista kohdistuu eteenpäin ja toinen taaksepäin, siellä on likimääräinen esitys H: stä2JOMPIKUMPI2.
Jos vartalo soittaa minkä tahansa indeksin, peukalot pyörivät vastauksena tähän vuorovaikutukseen; He kuitenkin palaavat heti alkuperäiseen asemaansa edellä mainittujen elektronisten torjuntojen takia. Nämä kierto kehittää tämän molekyylin dynaamiset näkökohdat.
Molekyylien väliset vuorovaikutukset
Nestetilassa h2JOMPIKUMPI2 onnistuu luomaan vety sillat (hooh-o2H2), muuten sen korkea kiehumispiste (150 ºC) ei selitetä veteen verrattuna.
Voi palvella sinua: kalsiumsulfaatti (tapaus4): kemiallinen rakenne, ominaisuudet, käyttötarkoituksetKun se kulkee kaasufaasiin, M -molekyylit2JOMPIKUMPI2 Oletettavasti ei enää voi muodostaa sellaisia siltoja, paitsi suurimpaan molekyylien väliseen etäisyyteen, myös vetyatomeja, jotka koskevat ensimmäisiä törmäysten tapauksessa (tämä voidaan visualisoida turvautumalla takaisin sormien malliin).
Samaan aikaan kiinteässä vaiheessa H: n määrittävien tasojen kulma on 90º (laita kohtisuorat sormet) sormet). Nyt vety sillat muuttuvat entistä tärkeämmiksi ja H -molekyyleistä2JOMPIKUMPI2 Ne on tilattu tetragonaalirakenteen kiteessä.
Ominaisuudet
Sbotella vetyperoksidilla. Apteekeissa se saavutetaan pitoisuudella 3% m/v. Lähde: Pixnio.
Nimeä
-Vetyperoksidi
-Dioksidano
-Oksidanoli
-Perhydoksihappo
-O-hydroksioli
-Vetyperoksidi
Moolimassa
34 0147 g/mol
Fyysinen ulkonäkö
Vaaleansininen (keskittynyt) tai väritön. Se on hieman viskoosista ja tiheämpi kuin vesi. Se on tislattu turvallisuuden vuoksi alhaisissa lämpötiloissa ja alentuneessa paineessa, koska se hajoaa räjähtävästi lämmittämällä.
Haju
Akuutti tai haju, joka on samanlainen kuin otsoni.
Maku
Katkera
Tiheys
Kiinteä 1,71 g/cm3
Niiden vesipitoisten liuosten tiheydet riippuvat niiden pitoisuudesta; Esimerkiksi 27 %: n tiheys on 1,10 g/cm3, kun taas 50 %, 1,13 g/cm3
Sulamispiste
- 0,43 ºC
Kiehumispiste
150,2 ºC. Tämä arvo on saatu ekstrapoloimalla, koska vetyperoksidi hajoaa korkeissa lämpötiloissa.
Vesiliukoisuus
Sekoittuu ≥ 100 mg/ml 25 ° C: ssa
Liukoisuus
Se liukenee eetteriin ja alkoholiin, mutta liukenematon öljyeetteriin. Se hajoaa vedessä ja happea monissa orgaanisissa liuottimissa.
Oktanoli/vesijakokerroin
Log p = - 0,43
Höyrynpaine
5 mmHg nopeudella 30 ºC.
Dissosiaatiovakio
Pka = 11,72
PHE
Vetyperoksidiliuokset ovat hieman happamia. Esimerkiksi yhden - 35%: n pH on 4,6; Mutta keskittyessä 90%: iin, pH: sta tulee vähemmän hapan: 5,1.
Taittumisindeksi (nD -d-A
1 4061
Goo
1 245 CPOISE 20 ° C: ssa.
Lämpökapasiteetti
1 267 J/g · K (kaasu)
2 619 J/g · K (neste)
Höyrystyslämpö
1 519 j/g · k
Vakaus
Stabiili suositelluissa olosuhteissa. Asetanylidien ja tinasuolojen lisääminen vakauttaa sitä enemmän.
Korroosio
Syövyttävä
Hajoaminen
Se hajoaa altistumalla valolle tai hapettavien ja pelkistävien aineiden läsnä ollessa. Se on myös hajotettu lämmittämällä. Kun se tarttuu, vesi ja happi vapautuvat, ja sitä suositellaan pH: n ja lämpötilan nousu, samoin kuin katlaasientsyymin läsnäololla.
Voi palvella sinua: natriumperoksidi (Na2O2): rakenne, ominaisuudet, käyttötarkoituksetPintajännitys
80,4 DINS/cm A 20 ºC
Reaktiivisuus
H2JOMPIKUMPI2 Se toimii hapettavana aineena raudan happoliitoissa (usko2+) Rautarauta (f3+) myös hapettele sulfiitti -ioni (niin32-) sulfaatti -ioni (niin42--A.
Se voi toimia myös pelkistävänä aineena emäksisten liuosten läsnä ollessa, vähentäen natriumhypokloriittia (NaOCL) ja kaliumpermanganaattia (KMNO4) Hapen vapautumisella.
Sovellukset
Valkaisu
Vetyperoksidia käytetään paperiteollisuudessa massan ja paperin valkaisussa, joka kuluttaa suurimman osan vuotuisesta tuotannostaan.
Desinfiointiaine
Vetyperoksid. Sitä käytetään myös suun huuhteluna ja lievän suun ärsytyksen lievittämiseksi suukappaleen tai ientulehduksen läsnäolosta johtuen.
Sitä käytetään myös pintojen desinfiointiin, jääkaapien sisäpuolelle, veden ja torjumaan liiallista bakteerien kasvua vesijärjestelmissä ja jäähdytystornissa. Vetyperoksidi vapauttaa happea -vapaat radikaalit, jotka hajottavat epäpuhtaudet.
Pesuaine
Vetyperoksidia käytetään vaatteiden valkaisuaineiden valmistuksessa, mukaan lukien natriumkarbonaatti. Tämä yhdiste on natriumkarbonaatin ja vetyperoksidin kompleksi.
Kosmeettinen sovellus
Laimennettua vetyperoksidia käytetään hiusten valkaisussa ennen värjäystä. Sitä käytetään myös hampaiden valkaisuun osana kotitekoista hammasvoidetta.
Ponneaine
Vetyperoksidia käytetään monoporikorttimina tai kaksisuuntaisen raketin hapettavana komponentina. Se hajottaa vapauttavan happea ja vettä, ominaisuus, joka mahdollisti sen käytön ponneaineena.
Reaktiosolu pumpataan katalyytin läsnäololla, joka kiihdyttää mainitun hajoamisen. Tämän aikana vesihöyry tuotetaan korkeassa lämpötilassa.
Kun höyry karkotetaan aukon kautta, tuottaa impulssin. Vuonna 1940 rakennettu V-80-sukellusvene, jota käytettiin vetyperoksidista syntyneissä happiturbiineissa; nimeltään Walter Turbine -järjestelmä.
Saada
Alun perin vetyperoksidi saatiin teollisesti ammoniumpersulfaatin hydrolyysillä [(NH4-A2S2JOMPIKUMPI8] tai ammoniumbisulfaatin elektrolyysi, NH4HSO4.
Vetyperoksidia saadaan teollisesti käyttämällä antrakinonin. Prosessi suoritetaan neljässä vaiheessa: hydraus, suodatus, hapettuminen, uutto ja puhdistus.
Voi palvella sinua: magnesiumfluoridi: rakenne, ominaisuudet, synteesi, käyttöHydraus
Alquilantroquinona on hydrattu ohittamalla vetykaasua alumiinioksidilla ladattujen vetyaineen ja pienen määrän katalyytin (paladium) läpi. Lämpötila ylläpidetään 45 ºC: ssa pysyvällä sekoituksella.
Alkyndrokinoni muunnetaan Alquiloantrahydroquinonaksi ja Tetrahydroalquilantrahydroquinoniksi, valitsemalla jälkimmäisen suurimman mukavuutensa seuraaville menettelyille.
Suodatus
Liuos sisälsi.
Hapetus
Suodatettu liuos hapettuu kulkemalla ilmaa sen läpi muodostaen matalan puhtauden vetyperoksidin.
Poisto ja puhdistus
Vetyperoksidilla varustettu liu. Vesi virtaa pylvään läpi, kun taas sen pumpataan vetyperoksidin liuos.
Vesi saavuttaa uuttolaitteen pohjan vetyperoksidin pitoisuudella välillä 25 - 35 % P/P. Sitten se puhdistetaan tyhjiötislauksella 30 % vetyperoksidipitoisuuteen. Lopuksi vakiintunut ja varastoitu.
Riskejä
 Vetyperoksidipoltto. Lähde: Bobjgalindo [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Vetyperoksidipoltto. Lähde: Bobjgalindo [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Vetyperoksidi on syövyttävä aine, joten ihokosketus aiheuttaa vakavaa ärsytystä väliaikaisen valkaisun lisäksi (ylivoimainen kuva). Se voi myös tuottaa silmävaurioita, kutinaa, salptia, punoitusta ja ampulien muodostumista.
Sen hengitys aiheuttaa ärsytystä nenässä, kurkussa ja keuhkoissa. Sillä välin toistuva altistuminen voi aiheuttaa keuhkoputkentulehdusta, yskä, flegmaa ja hengityksen lyhenemistä. Ja ikään kuin se ei olisi tarpeeksi, se aiheuttaa myös päänsärkyä, vahidia, pahoinvointia ja oksentelua.
Vetyperoksidin vakava altistuminen voi tuottaa nestemäistä kertymistä keuhkoihin, mikä tunnetaan keuhkojen turvotuksena: vakava tila, joka vaatii nopeaa lääkärinhoitoa.
Työturvallisuus- ja työterveysaston (OSHA) on vakiinnuttanut 1 ppm: n vetyperoksidin maksimaalisen sallimat työympäristössä 8 tunnin päivänä. Koska se on mutageeninen yhdiste, altistuminen minimille on kuitenkin vähennettävä.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Vetyperoksidi. Haettu: vuonna.Wikipedia.org
- William R. Busing ja Henri a. Perimä. (2004). Vetyperoksidin kide- ja molekyylirakenne: neutroni -diffraktiotutkimus. doi.org/10.1063/1.1696379
- Kansallinen bioteknologiatietojen keskus. (2019). Vetyperoksidi. Pubchem -tietokanta. CID = 784. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Enyclopaedia Britannica -toimittajat. (27. marraskuuta 2018). Vetyperoksidi. Encyclopædia britannica. Toipunut: Britannica.com
- New Jerseyn terveysministeriö. (2016). Vetyperoksidi. [PDF]. Palautettu: NJ.Hallitus
- Mathews, c. K -k -., Van Holde, K. JA., Ahern, k. G. (2002). Biokemia. Kolmas painos. Pearson Addison Wesley toimitus
- MD -verkko. (2019). Vetyperoksidi. Haettu: WebMD.com
- « Atsteekkilääketiede, Jumala, kasvit, sairaudet
- Sinkkioksidirakenne (ZnO), ominaisuudet, käyttö, riskit »

