Peroksidit ominaisuudet, nimikkeistö, käyttö, esimerkkejä
- 4761
- 1129
- Ronald Reilly
Se peroksidit Ne ovat kaikki ne kemialliset yhdisteet, jotka sisältävät peroksiryhmän, O-O, joko kovalenttisesti kytkettynä hiiliatomeihin tai muihin funktionaalisiin ryhmiin tai ionisessa muodossa, kuten peroksidianionissa, tai22-. Yllä oleva on esitetty graafisesti alla olevassa kuvassa. Siinä O-O-ryhmä erottuu sinisellä värillä.
Voi olla orgaanisia peroksideja, kuten diaquilperoksideja (R1-O-o-r2), Hydroperoksidit (R-O-O-H), persidit (RCO-O-O-H) ja Peéstres (R1Co-o-o-r2-A. Meillä on myös epäorgaanisia peroksideja, kuten metalliperoksidit (Mn+JOMPIKUMPI22-) ja vetyperoksidi (H-O-H). Jälkimmäinen on tunnetuin kaikista, ja se vastaanottaa vetyperoksidin nimen.
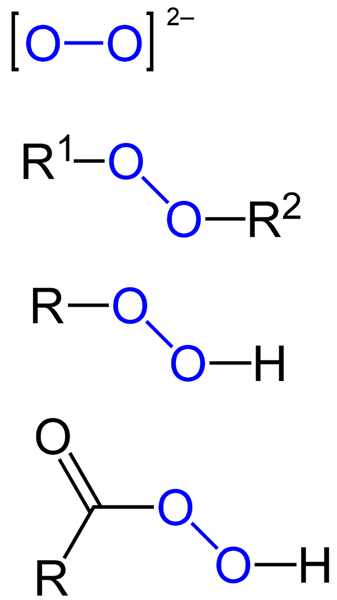 Kaavat erityyppisille peroksideille, jotka ovat olemassa. Lähde: Jü / julkinen verkkotunnus
Kaavat erityyppisille peroksideille, jotka ovat olemassa. Lähde: Jü / julkinen verkkotunnus Kaikilla peroksideilla on yhteinen ominaisuus olla erittäin reaktiivisia, hapettavia aineita ja joissain tapauksissa räjähtäviä. Ellei niitä ole määritelty syntetisoimalla niitä, niitä pidetään ei -toivottuina ja vaarallisina epäpuhtauksilla monille teollisuusprosesseille ja laboratoriosynteesille.
Peroksidit yleensä ovat erinomaisia hapettumisaineita, valkaisua, bakterikien torjunta -aineita ja polymerointiaktivaattoreita vapaan radikaalin muodostumisen kautta. Siksi ne ovat yleensä erittäin hyödyllisiä reagensseja tai lisäaineita polymeeriteollisuudessa sekä elintarviketeollisuudessa nopeuttamaan hapettumisia ja poistamaan bakteereja.
[TOC]
Peroksidiominaisuudet
Rakenne
Peroksidirakenteet keskittyvät O-O-ryhmään. Jokaisella happiatomilla on SP -hybridisaatio3, Joten linkit -o -do ei lepää samassa tasossa. Esimerkiksi vetyperoksidille, H-O-H, kahden tunnin välinen kulma on 115.5., joka osoittaa, että neljä atomia ei ole lentokoneessa.
Tämän ja muiden näkökulmien vääristymät riippuvat muiden O-O-ryhmään liittyvien molekyylifragmenttien identiteetistä.
Se voi palvella sinua: Gibbs Free Energy: Yksiköt, miten se lasketaan, ratkaistu harjoituksetToisaalta orgaaniset ja epäorgaaniset peroksidit (paitsi metallit) voidaan tunnistaa paljaalla silmällä, jos O-O. Tällä tavalla mikä tahansa peroksidi tunnistetaan välittömästi yhdellä näkemyksellä sen rakenteesta.
Reaktiivisuus
O-O-linkki on suhteellisen heikko verrattuna muihin linkkeihin, kuten C-H tai C-O. Siksi sillä on taipumus rikkoa tai fragmentti tuottaa erittäin reaktiivisia hapetettuja radikaaleja.
Ne johtuvat näiden radikaalien takia, että peroksidit luokitellaan reaktiivisiksi ja vaarallisiksi aineiksi, koska ne voivat vahingoittaa kudoksia ja kaikkia orgaanisia aineita.
Hapettava vaikutus
Peroksidit ovat voimakkaita hapettavia aineita, jotka pyrkivät saamaan elektroneja ympäristöstä muuttumaan veteen, happea tai hydroksideiksi. Esimerkiksi vetyperoksidi on voimakkaampi hapettiaine kuin sama kaliumpermanganaatti.
Tätä hapettavaa vaikutusta käytetään havaitsemaan ne reaktion kautta rautasulfaatin ja kalium -tiosyanaatin kanssa:
Peroksidi +usko2+ + SCN- → Fe (SCN)n(3-N)- (N = 1 - 6).
Uskon välillä muodostettu kompleksi3+ ja SCN- Se on veripunainen, joten tämän värin havaitseminen vastaa positiivista testiä peroksidien esiintymiselle näytteessä.
Herkkyys
Peroksidit ovat aineita, jotka ovat herkkiä korkeille lämpötiloille ja auringonvalolle. Siksi ne on säilytettävä turvallisiin kohteisiin ja muovi- ja läpinäkymättömiin astioihin, joten valo ei vaikuta heihin suoraan.
Nimikkeistö
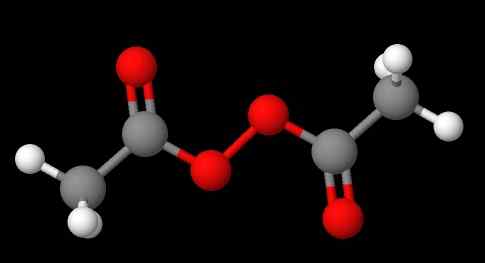
Peroksidien nimikkeistö riippuu siitä, minkä tyyppiset ne kuuluvat. Yleensä monet nimitetään mainitsemalla 'peroksidi', jota seuraa substituentit r aakkosjärjestyksessä. Esimerkiksi yhdistelmä CH3C (O) OOC (O) CH3 (Alempi kuva) kutsutaan diacetyyli- tai asetyyliperoksidiksi, koska siinä on asetyyliryhmä molemmissa päissä.
Voi palvella sinua: natriumsulfaatti (Na2SO4): rakenne, ominaisuudet, käyttötarkoitukset, hankkiminen Diasetyyliperoksidi. Lähde: Gabriel Bolívar Molviewin kautta.
Diasetyyliperoksidi. Lähde: Gabriel Bolívar Molviewin kautta. Yhdiste C6H5C (O) OOC (O) C6H5 (Alempi kuva), toisaalta, sitä kutsutaan dibenzoílo tai benzoílo peroksidiksi samoista syistä, jotka on esitetty edellisessä kappaleessa.
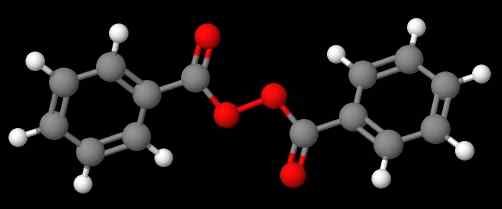 Bentsoyyliperoksidi. Lähde: Gabriel Bolívar Molviewin kautta.
Bentsoyyliperoksidi. Lähde: Gabriel Bolívar Molviewin kautta. Sillä välin yhdiste C6H5C (O) OOC (O) CH3 kutsutaan asetyylibentsolelo -peroksidiksi. Tällä kertaa asetyylisubstituentti mainitaan ensin aloittamiseen kirjaimella 'a'. Toinen esimerkki on ch3CH2OOC6H5, kutsutaan etyylifenyyliperoksidiksi.
Samoin jatka hydroperoksideilla. Esimerkiksi Cho3OOH kutsutaan metyylihydroperoksidiksi.
Koulutus
Jotkut peroksidit voidaan muodostaa suoraan kyseisen aineen altistumisella ilman happea, avustettua tai ei metallikatalyytteillä. Ne voivat muodostua myös paljastamalla aine otsonille tietyissä olosuhteissa, suorittamalla otsonolyysireaktiota.
Toinen synteettinen reitti on vetyperoksidin reagoiminen alkylorsulfaatin kanssa:
R -2Sw4 + H2JOMPIKUMPI2 → R-O-R +H2Sw4
Diakilic -peroksidien tai jopa syklisten peroksidien syntetisoimiseksi tai muodostamiseksi.
Samaan aikaan monet metalliperoksidien muodostamista menetelmistä perustuvat vastaavien metallioksidien hapettamiseen, niin että ne "happea" ja menevät Mo: sta (Mn+JOMPIKUMPI2-) Rakkaus2 (Mn+JOMPIKUMPI22--A.
Peroksidit käyttävät
Polymerointi -aloittajat
Peroksidit, erityisesti orgaaniset peroksidit, lisätään reaktiovälineisiin muovien ja materiaalien, kuten polystyreenin, silikonin, epoksi- ja akryylihartsien, polyvinyylikloridin, lasikuitujen, välissä olevien materiaalien ja materiaalien, kuten polyvinyylikloridin, synteesiin synteesistä.
Tämä johtuu siitä, että he kärsivät lämpöhajoamisista hapettuneiksi vapaiksi radikaaleiksi, jotka puolestaan laukaisevat ja katalysoivat polymerointeja. Siksi ne ovat toivottavia polymeeriteollisuudessa.
Se voi palvella sinua: molaarinen fraktio: miten se lasketaan, esimerkkejä, harjoituksiaJotkut initiaattorina käytetyistä peroksideista ovat metyylisetona (MEK) peroksidi ja asetoniperoksidi.
Valkaisu- ja desinfiointiaineet
Peroksidit ovat valkaisuaineita, joita käytetään paperin valkaisuun ja jauhojen massaan. Ne ovat myös desinfiointiaineita, täysin tehokkaita, mutta aggressiivisia bakteerien tuhoamisen suhteen. Klassinen esimerkki vastaa vetyperoksidia, joka on tarkoitettu laimennettuihin liuoksiin (3%) haavojen desinfiointiin.
Hapettavia aineita
Peroksidit ovat myös hapettavia aineita, joten ne löytävät monia käyttötarkoituksia hyvin hapetettujen aineiden orgaanisessa synteesissä.
Happilähteet
Vaikka peroksidit eivät ole pääkäyttöönsä, se voi toimia myös happilähteinä joissakin niiden hajoamisissa. Tämä on jälleen vetyperoksidin tilanne.
Esimerkkejä peroksideista
Lopuksi luetellaan joitain esimerkkejä peroksideista, olivatpa ne orgaanisia tai epäorgaanisia, niiden kaavoilla ja vastaavilla nimillä:
-H2JOMPIKUMPI2: Vety- tai vetyperoksidi
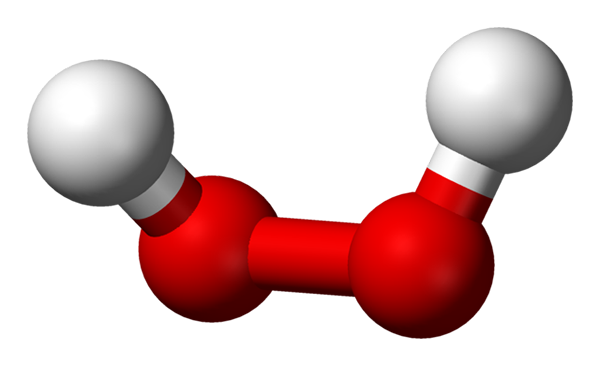 Vetyperoksidimolekyyli, jota esitetään palloilla ja baarimallilla. Lähde: Benjah-BMM27 Wikipedian kautta.
Vetyperoksidimolekyyli, jota esitetään palloilla ja baarimallilla. Lähde: Benjah-BMM27 Wikipedian kautta. -Naa2JOMPIKUMPI2: natriumperoksidi
-Palkki2: bariumperoksidi
-C6H5C (CH3-A2OOH: Cummeno -hydroperoksidi
-(NH4-A2S2JOMPIKUMPI8: Ammonium persulfaatti
- Hote3Sotilas3H: peroksidisulfuriinihappo
-(CH3-A3COOC (CH3-A3: Ditert-butyyliperoksidi
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10th Painos.-A. Wiley Plus.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Orgaaninen peroksidi. Haettu: vuonna.Wikipedia.org
- Elsevier B.V. (2020). Peroksidi. Tiede. Haettu: ScienEdirect.com
- Kehittynyt kemian kehittäminen. (S.F.-A. Alkoholit, fenolit ja niiden johdot:
- Peroksidien sääntö C-218. Palautettu: ACDLABS.com
- Vol'nov i.Yllyttää., Petrocelli a.W -. (1966) epäorgaanisten peroksidiyhdisteiden luokittelu ja nimikkeistö. Julkaisussa: Petrocelli a.W -. (Toim.) Alkalin ja alkalisen maan metallien peroksidit, superoksidit ja otsonidit. Springer, Boston, MA.
- « Tyypillinen Baja California Sur miehille ja naisille (kuvaus)
- Haloidimyynti kiinteistöt, nimikkeistö, miten ne muodostetaan, esimerkkejä »

