Haloidimyynti kiinteistöt, nimikkeistö, miten ne muodostetaan, esimerkkejä

- 3693
- 61
- Shawn Stanton II
Se halosäsuolat Ne ovat binaarisia yhdisteitä, jotka on muodostettu metallilla ja ei -metallilla, ilman mitään muuta elementtiä. Nämä suolat muodostuvat neutralointireaktiolla vesihapon kanssa emäksen kanssa. Esimerkiksi: Reaktio suolahapon (HCL) välillä natriumhydroksidin (NaOH) kanssa natriumkloridin (NaCl) muodostamiseksi (NaCl).
Haloidiset suolat muodostetaan myös hydraatin reaktiolla metallin kanssa. Esimerkiksi: magnesiumreaktio suolahappon kanssa magnesiumkloridin muodostamiseksi (MGCL2-A. Kuten nähdään, kloridit ovat edustavimpia haloidisuoloja. Ne eivät kuitenkaan ole ainoita.
 Halita, natriumklorid. Lähde: http: // gl.Wikipedia.org/w/indeksi.Php?Otsikko = käyttäjä: Shinichi / julkinen verkkotunnus
Halita, natriumklorid. Lähde: http: // gl.Wikipedia.org/w/indeksi.Php?Otsikko = käyttäjä: Shinichi / julkinen verkkotunnus Haloidisuolat ymmärtävät joidenkin määritelmien mukaan yhdisteet, joita ne sisältävät halogeenirakenteessaan; Toisin sanoen: fluori, kloori, bromi ja jodi, joten niitä pidetään synonyyminä halogenideille tai halogeenille.
Samoin haloidisuoloihin sisältyy jotkut kirjoittajat, yhdisteet, jotka muodostuvat metallin liitoksesta elementin kanssa, joka käyttää sen negatiivista valenssia, mukaan lukien: karbidit, nitridit, fosfurot, sulfidit, seleniuros, arseniuros jne. Nämä lasketaan myös haloidisuoloiksi aina, kun ne koostuvat kahdesta elementtiä.
[TOC]
Haloidimyynti kiinteistöt
Haloidisuolat ovat ryhmä yhdisteitä, joiden ominaisuuksia on vaikea luoda.
Vahvat ioniset yhteydet
Yleensä ne koostuvat kiinteistä aineista, joilla on vahvat ionisidokset kahden elementin ionien välillä: M+X-, missä m+ vastaa metallista kationia ja x- Anionista johdettu ei -metallista.
Korkeat sulamispisteet, kiehuminen ja sublimointi
Heillä on yleensä erittäin korkea fuusio-, kiehumis- ja sublimointipisteet, jotka johtuvat juuri sen kiteisen rakenteen voimasta.
Se voi palvella sinua: DAPI (4 ', 6-Diamidino-2-fenyylindoli): Ominaisuudet, perusta, käyttöSähkönjohtavuus
Solid -tilassa ne ovat huonoja sähkönjohtimia, mutta vesipitoisessa liuoksessa ionisoidessaan tai sulautuessaan hyvistä kuljettajista tulee.
Ulkomuoto
Ne ovat kiteisiä kiinteitä aineita, joista fragmentoituja jauhemaisia voi tulla valkoinen väri. Monilla haloidisuoloilla voi kuitenkin olla erilainen väri. Esimerkiksi nikkelikloridi on vihreää, kun taas ferrikloridi on värähtelevä väri vihreän ja punaisen välillä.
Liukoisuus
Suurin osa Haluros -suoloista liukenee veteen, lukuun ottamatta hopeaa, lyijyä (II) ja elohopeahalogenideja (i).
Haju
Koska ne eivät ole haihtuvia yhdisteitä, haloidisuolat eivät ole vahvoja hajuja. Koostumuksensa vuoksi he voivat olla hapanta, suolaista, katkeraa tai makeita makuja.
Nimikkeistö
Haloidisuolat on nimetty asettamalla anionin nimi jälkiliitteellä aurochit, jota seuraa suoraan metallin nimi, ennen konjunktiota -. Jos metallilla on useampi kuin yksi valenssi, metalli sijoitetaan jälkiliitteeseen Karhu tai ICO, Hänen Valenciasta riippuen.
Metallin nimi voidaan myös sijoittaa ilman jälkiliittoa ja hapettumisen lukumäärää suluissa.
Esimerkiksi: rautakloridi (III) tai ferrikloridi, FECL3.
Kuinka haloidisuolat muodostetaan?
Haloidisuolat muodostuvat pääasiassa kolmella reaktiolla: neutralointi, happoreaktio metallin kanssa ja metallin reaktio metallilla tai ei -metallisella toiminnalla negatiivisella valenssilla.
Neutralointireaktio
Se on hapon reaktio emäksellä, tuottaa suolaa ja vesimolekyyliä. Esimerkiksi:
HCL +NaOH → NaCl +H2JOMPIKUMPI
Tämä esimerkki mainittiin prinssille.
Hapon reaktio metallilla
Vahva happo voi reagoida metallin kanssa, joka on peräisin suolasta ja vedyn vapautumisesta (H2-A. Esimerkiksi: suolahappo reagoi sinkin (Zn) kanssa sinkkikloridin muodostamiseksi (ZnCL2)
Voi palvella sinua: Analyyttinen kemiaZn +HCL → Zncl2 + H2
Metallin yhdistelmä metallilla tai ei -metallilla
Nämä haloidisuolat johtuvat metallin yhdistelmästä metallin kanssa tai ei -metallia halogeeneistä. Esimerkiksi: Alumiinifosfuro yhdistää fosforin Valencia -3: n kanssa alumiiniin Valencia +3: n kanssa. Nyt tämä "yhdistelmä" johtuu jokaisesta suolasta erityisistä tuotantoreaktioista.
Käyttää/sovelluksia
Metallihalogenurot
Metallihalogenuroja käytetään korkean intensiteetin lamppuissa, kuten nykyaikaiset lamput. Niitä käytetään myös kasvihuoneissa tai sadesilmiöissä täydentämään luonnollista valoa. Hopeahalideja käytetään elokuvissa ja valokuvapapereissa.
Kalsiumkloridi
 Kalsiumkloridin esiintyminen
Kalsiumkloridin esiintyminen Kalsiumkloridia käytetään kalsiumlähteenä jäteveden käsittelyssä. Sitä käytetään myös kalsiumlähteenä sen elektrolyysin kautta. Sitä käytetään sydämen rytmihäiriöiden hoidossa ja vakavan hypokalsemian tapauksessa.
Ferrikloridi
Ferrikloridia käytetään jäteveden käsittelyssä ja vedenpuhdistuksessa. Sitä käytetään myös kuparin tallentamiseen tai valitsemiseen ja puuttumiseen katalysaattorina vinyylikloridin synteesiprosessissa.
Kloridi- ja kaliumbromidi
Kaliumkloridia käytetään lannoitteena ja hypokalemian tai hypokalemian hoidossa. Toisaalta kaliumbromidia käytettiin kouristuksena, ja sitä käytetään tällä hetkellä lääketeollisuudessa ja pukeutumisena.
Kloridi- ja natriumsulfidi
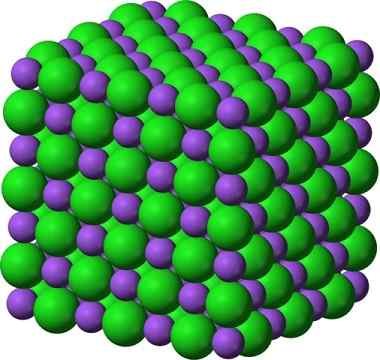
 Natriumkloridin, NaCl, tyypillisen ionisen yhdisteen kiteinen rakenne. __ violetti pallot edustavat natriumkationeja, Na +: ta, ja __ vihreät pallot edustavat ancies -kloridia, cl−.
Natriumkloridin, NaCl, tyypillisen ionisen yhdisteen kiteinen rakenne. __ violetti pallot edustavat natriumkationeja, Na +: ta, ja __ vihreät pallot edustavat ancies -kloridia, cl−. Natriumkloridia käytetään elintarvikkeina lihan säilyttämisessä antiseptisenä, vaikeassa hyponatremiassa jne. Natriumsulfidia käytetään raskaan veden tuotannon ydinreaktoreissa, nahkojen karvojen eliminoinnissa sekä kumien, väriaineiden ja maalausten valmistuksessa.
Voi palvella sinua: alumiinioksidi: rakenne, ominaisuudet, käytöt, nimikkeistöPhosphuros ja Nitturos
Alumiinifosfuroa käytetään leveä nauhan puolijohteena ja hyönteismyrkkynä. Samaan aikaan Gallium Nitruroa käytetään puolijohteena.
Esimerkkejä haloidisuoloista
Edellisessä osassa mainittujen esimerkkien lisäksi muut halo -suolat niiden kaavoilla ja nimillä:
-NaCl: Natriumkloridi
-KCL: Kaliumkloridi
-Kacl2: Kalsiumkloridi
-Mgcl2: Magnesiumkloridi
-CSCL: Cesiumkloridi
-Bacl2: Bariumkloridi
-FECL2: Rautakloridi
-FECL3: Ferrikloridi
-Nikl2: Nikkelikloori
-CUCL: Kukloridi
-Cucl2: Kupikloridi
-AGCL: Hopeakloridi
-Zncl2: Sinkkikloridi
-CDCL2: Kadmiumkloridi
-HGCL2: Elohopeakloridi
-ALCL3: Alumiinikloridi
-NABR: Natriumbromidi
-KBR: Kaliumbromidi
-CSBR: Cesiumbromidi
-CDBR: Kadmiumbromidi
-Mgbr2: Magnesiumbromidi
-Srbr2: Strontiumbromidi (II)
-KI: Kalium Yoduro
-NAI: Natriumjodidi
-CSI: Cesium Yoduro
-Ali3: Alumiinijodidi
-BKT2: Lyijyjodidi (II)
-NAF: Natriumfluori
-LIF: Litiumfluori
-Kahvila2: Kalsiumfluori
-Ptf2: Platinum -fluori (II)
-Nas2: Natriumsulfidi
-Li4C: Litiumkarbidi
-Mg2C: Magnesiumkarbidi
-ALP: Alumiinifosfuro
-Joo3N4: Piilakenteinen nitruro
-Tina: Titanium Nitruro
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Julián Pérez Porto ja María Merino. (2016). Haloidisuolojen määritelmä. Määritelmä.-. Palautettu: Määritelmä.-
- James P. Birk. (5. kesäkuuta 2019). Halogenki. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Wikipedia. (2020). Hiilidioksidi. Haettu: vuonna.Wikipedia.org
- « Peroksidit ominaisuudet, nimikkeistö, käyttö, esimerkkejä
- Termohigometrin ominaisuudet, funktiot, osat, käytöt »

